题目内容
【题目】现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(约6 mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。
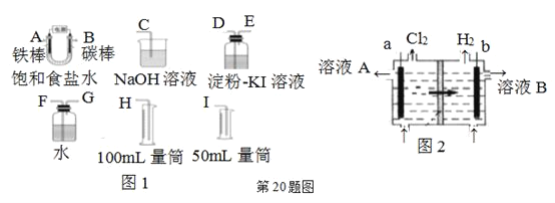
(1)试从上图图1中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是:A接________,B接________。
(2)铁棒接直流电源的________极;碳棒上发生的电极反应为________。
(3)能说明氯气具有氧化性的实验现象是________。
(4)假定装入的饱和食盐水为50 mL(电解前后溶液体积变化可忽略),当测得的氢气为5.6 mL(已折算成标准状况)时,溶液的pH为________。
(5)工业上采用离子交换膜法电解饱和食盐水,如上图图2,该离子交换膜是________(填“阳离子”或“阴离子”)交换膜,溶液A是________(填溶质的化学式)
【答案】G、F、I D、E、C 负 2Cl--2e-=Cl2↑ 淀粉-KI溶液变成蓝色 12 阳离子 NaCl
【解析】
(1)A为铁棒,则应为阴极,产生H2;B为阳极,产生Cl2;据此确定后续连接装置;
(2)铁棒为阴极,与电源的负极相连;碳棒为阳极,由Cl-发生失电子的氧化反应,生成Cl2,据此写出电极反应式;
(3)氧化性Cl2>I2,淀粉遇碘变蓝色;
(4)根据公式![]() 计算反应生成n(H2),结合电极反应式计算反应生成n(OH-),再根据
计算反应生成n(H2),结合电极反应式计算反应生成n(OH-),再根据![]() 计算溶液中c(H+),从而得出溶液的pH;
计算溶液中c(H+),从而得出溶液的pH;
(5)电极a产生Cl2,则电极a为阳极,电极b为阴极,根据离子移动方向,确定离子交换膜的类型和溶液A的成分;
(1)A为铁棒,则应为阴极,产生H2,则A后应连接测量H2体积的装置,因此A接G、F、I;B为阳极,产生Cl2,则B后连接Cl2的性质检验装置,因此B接D、E、C;故答案为:G、F、I,D、E、C。
(2)铁棒为阴极,与电源的负极相连;碳棒为阳极,由Cl-发生失电子的氧化反应,生成Cl2,故答案为:![]() ;
;
(3)由于氧化性Cl2>I2,能将I-氧化成I2,而淀粉遇碘变蓝色,因此若观察到淀粉-KI溶液变成蓝色,则说明Cl2具有氧化性,故答案为:淀粉-KI溶液变成蓝色。
(4)反应生成![]() , 由电极反应式2H2O+2e-=H2↑+2OH-可知,反应生成n(OH-)=0.5×10-3mol,则溶液中
, 由电极反应式2H2O+2e-=H2↑+2OH-可知,反应生成n(OH-)=0.5×10-3mol,则溶液中![]() , 因此溶液中
, 因此溶液中 , 因此溶液的pH=12,故答案为:12。
, 因此溶液的pH=12,故答案为:12。
(5)由于电极a产生Cl2,则电极a为阳极,电极b为阴极;由图可知,离子由电极a区域向电极b区域移动,因此移动的离子为阳离子,因此离子交换膜为阳离子交换膜;因此溶液A为NaCl稀溶液,故答案为:阳离子,NaCl。

 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案