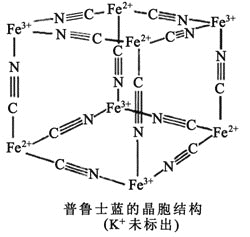
题目内容
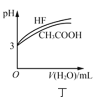
【题目】钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法不正确的是( )

A.盐酸的浓度越大,腐蚀速率越快
B.碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
C.钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
D.对比盐酸和硫酸两条曲线,可知Cl-也可能会影响碳素钢的腐蚀速率
【答案】B
【解析】
A.由图可知,盐酸的浓度越大,腐蚀速率越快,故A说法正确;
B.碳素钢的腐蚀速率不随硫酸浓度增大而增大,但腐蚀速率会随盐酸的浓度增大而加快,可推测是由于SO42-浓度引起的,故B说法错误;
C.由图可知,当钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小,故C说法正确;
D.由于腐蚀速率随盐酸浓度的增大而增大,随硫酸浓度的增大,出现先增大后减小的现象,因此可说明Cl-、SO42-都会影响碳素钢的腐蚀速率,故D说法正确;
故答案为B。

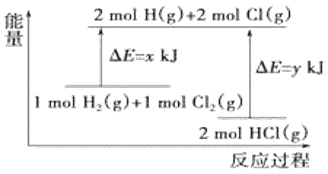
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl22H2O的流程如下:

(1)毒重石用盐酸浸取前需充分研磨,目的是____________________。实验室用37%的盐酸配制15%的盐酸,除量筒外还需使用下列仪器中的______________。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3H2O调节pH=8可除去_____(填离子符号),滤渣Ⅱ中含______(填化学式)。加入H2C2O4时应避免过量,原因是_________________。
已知:Ksp(BaC2O4)=1.6×10﹣7,Ksp(CaC2O4)=2.3×10﹣9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42﹣+2H+═Cr2O72﹣+H2O Ba2++CrO42﹣═BaCrO4↓
步骤Ⅰ:移取x ml一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b molL﹣1盐酸标准液滴定至终点,测得滴加的盐酸体积为V0 mL。
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b molL﹣1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的______________(填“上方”或“下方”)。BaCl2溶液的浓度为______________ molL-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将______________(填“偏大”或“偏小”)。
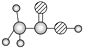
【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
B | ①由C.H两种元素组成;②球棍模型为 |
C | ①由C.H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为88的酯 |
D | ①由C.H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)A与溴的四氯化碳溶液反应的化学方程式为:___;反应类型___。
(2)B具有的性质是___(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
(3)C所含官能团的名称是___,D所含官能团的名称是___,C和D发生酯化的反应方程式___。