题目内容
【题目】常温下,下列溶液中,有关微粒物质的量浓度关系正确的是( )
A. 0.1mol·L-1(NH4)2Fe(SO4)2溶液:c(![]() )>c(
)>c(![]() )>c(H+)>c(Fe2+)
)>c(H+)>c(Fe2+)
B. 将100mL 0.1mol·L-1Na2CO3溶液逐滴滴加到100mL 0.1mol·L-1盐酸中:c(Na+)>c(C1-)>c(![]() )>c(
)>c(![]() )
)
C. pH=12的NaOH溶液与等体积pH=2的醋酸溶液混合后:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D. 0.1mol·L-1NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(![]() )
)
【答案】C
【解析】
A. 0.1molL1(NH4)2Fe(SO4)2溶液中铵根离子、亚铁离子水解,溶液显酸性,离子浓度大小为: c(SO42)> c(NH4+)>c(Fe2+)>c(H+),故A错误;
B. 将100mL 0.1molL1Na2CO3溶液逐滴滴加到100mL 0.1molL1盐酸中,碳酸钠与过量盐酸反应生成氯化钠、二氧化碳气体和水,最终得到氯化钠和碳酸钠的混合物,钠离子、氯离子不水解,碳酸根离子部分水解,则离子浓度大小为:c(Na+)>c(Cl)>c(CO32)>c(HCO3),故B错误;
C. pH=12 NaOH溶液与等体积pH=2的醋酸混合后的溶液中,醋酸为弱酸又电离出醋酸根离子和氢离子,溶液显酸性,离子浓度大小为:c(CH3COO)>c(Na+)>c(H+)>c(OH),故C正确;
D. 0.1molL1NaHCO3溶液中电荷守恒式为:c(H+)+c(Na+)=c(OH)+2c(CO32)+c(HCO3),物料守恒式为:c(Na+)=c(CO32)+c(HCO3)+c(H2CO3),得到离子浓度关系c(H+)+c(H2CO3)=c(OH)+c(CO32),故D错误;
答案选C。

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77 kJmol-1
CH3OH(g) △H3=-90.77 kJmol-1
回答下列问题:
(1)反应Ⅱ的△H2=_________,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2=________(用K1、K3表示)。
(2)反应Ⅲ自发进行条件是___________(填“较低温度”、“较高温度”或“任何温度”)。
(3)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如下表所示。
温度(℃) | 500 | T |
CO2的平衡转化率 | 60℅ | 40℅ |
①T______500℃(填“>”、“<” 、“=”)。
②温度为500℃时,该反应10 min时达到平衡。用H2表示该反应的反应速率v(H2)=______________;该温度下,反应I的平衡常数K=______________L2/mol2
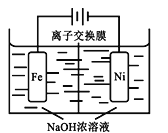
(4)由CO2制备甲醇还需要氢气。工业上用电解法制取Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图所示。电解一段时间后,c(OH)降低的区域在__________ (填“阴极室”或“阳极室”)。该室发生的电极反应式为:___________________________。
FeO42+3H2↑,工作原理如图所示。电解一段时间后,c(OH)降低的区域在__________ (填“阴极室”或“阳极室”)。该室发生的电极反应式为:___________________________。