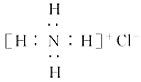题目内容
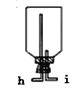
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
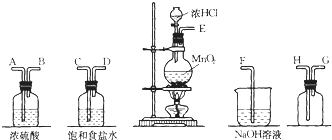
(1)连接上述仪器的正确顺序是:E接__,__接__,__接__,__接F。
(2)气体发生装置中进行的反应化学方程式是__;当0.5molMnO2参与反应时,生成的Cl2在标准状况下的体积约__。
(3)在装置中:①饱和食盐水的作用是__,②浓硫酸的作用是___。
(4)化学实验中检验是否有Cl2产生常用湿润的淀粉-KI试纸。如果有Cl2产生,可观察到的现象是___。
(5)写出尾气吸收装置中进行的反应的化学方程式__。
【答案】C D A B H G 4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O 11.2L 除去Cl2中的HCl 干燥氯气 试纸变蓝 Cl2+2NaOH=NaCl+NaClO+H2O
MnCl2+Cl2↑+2H2O 11.2L 除去Cl2中的HCl 干燥氯气 试纸变蓝 Cl2+2NaOH=NaCl+NaClO+H2O
【解析】
(1)制备干燥纯净的氯气的步骤是制取、除杂、干燥、收集、尾气处理;
(2)气体发生装置D中是二氧化锰、浓盐酸在加热条件下生成氯化锰、氯气、水;根据方程式计算生成的Cl2在标准状况下的体积;
(3)①饱和食盐水可以除去氯气中的氯化氢,②浓硫酸具有干燥作用;
(4)淀粉遇碘单质变蓝色;
(5)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;
(1)制备干燥纯净的氯气的步骤包括:制取、用饱和食盐水除去氯气中的氯化氢、用浓硫酸干燥氯气、用向上排空气法收集收集氯气、用氢氧化钠溶液吸收尾气,所以连接上述仪器的正确顺序是:E接C,D接A,B接H,G接F;
(2)气体发生装置D中是二氧化锰、浓盐酸在加热条件下生成氯化锰、氯气、水,反应方程式是4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
设生成氯气的体积是VL;
4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
1mol 22.4L
0.5mol VL
![]()
V=11.2L;
(3)①饱和食盐水可以除去氯气中的氯化氢,饱和食盐水的作用是除去Cl2中的HCl ;②浓硫酸具有干燥作用,所以浓硫酸的作用是干燥氯气;
(4)Cl2能置换出KI中的碘,淀粉遇碘单质变蓝色。如果有Cl2产生,可观察到的现象是试纸变蓝;
(5)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,反应方程式是Cl2+2NaOH=NaCl+NaClO+H2O。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案