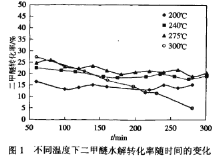
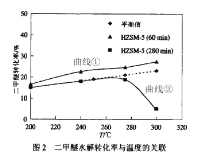
题目内容
【题目】氮化钡(Ba3N2)是一种重要的化学试剂。高温下,向氢化钡(BaH2)中通入氮气可反应制得氮化钡。已知:Ba3N2遇水反应;BaH2在潮湿空气中能自燃,遇水反应。用图示装置制备氮化钡时,下列说法不正确的是( )
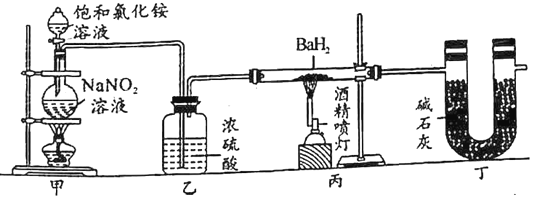
A.装置甲中反应的化学方程式为NaNO2+NH4Cl![]() N2↑+NaCl+2H2O
N2↑+NaCl+2H2O
B.BaH2遇水反应,H2O作还原剂
C.实验时,先点燃装置甲中的酒精灯,反应一段时间后,再点燃装置丙中的酒精喷灯进行反应
D.装置乙中的浓硫酸和装置丁中的碱石灰均是用于吸收水蒸气,防止水蒸气进入装置丙中
【答案】B
【解析】
A. 装置甲中亚硝酸钠和氯化铵发生归中反应生成氮气,根据电子守恒,反应的化学方程式为NaNO2+NH4Cl![]() N2↑+NaCl+2H2O,故A正确;
N2↑+NaCl+2H2O,故A正确;
B. BaH2中H元素化合价为-1,BaH2遇水反应生成氢气,H2O作氧化剂,故B错误;
C. 实验时,先点燃装置甲中的酒精灯,反应一段时间后,等氮气把装置中的空气排出后,再点燃装置丙中的酒精喷灯进行反应,故C正确;
D. Ba3N2遇水反应,BaH2在潮湿空气中能自燃,遇水反应,所以装置乙中的浓硫酸和装置丁中的碱石灰均是用于吸收水蒸气,防止水蒸气进入装置丙中,故D正确;
选B。

【题目】制造一次性医用口罩的原料之一丙烯是三大合成材料的基本原料,丙烷脱氢作为一条增产丙烯的非化石燃料路线具有极其重要的现实意义。丙烷脱氢技术主要分为直接脱氢和氧化脱氢两种。
(1)根据下表提供的数据,计算丙烷直接脱氢制丙烯的反应C3H8(g)![]() C3H6(g) +H2(g)的H=___。
C3H6(g) +H2(g)的H=___。
共价键 | C-C | C=C | C-H | H-H |
键能/(kJmol-1) | 348 | 615 | 413 | 436 |
(2)下图为丙烷直接脱氢制丙烯反应中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中压强分别为1×104Pa和1×105Pa)
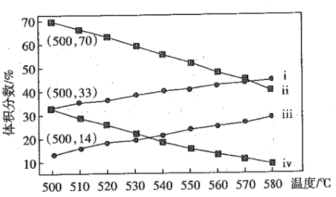
①在恒容密闭容器中,下列情况能说明该反应达到平衡状态的是__(填字母)。
A.H保持不变
B.混合气体的密度保持不变
C.混合气体的平均摩尔质量保持不变
D.单位时间内生成1molH-H键,同时生成1molC=C键
②欲使丙烯的平衡产率提高,下列措施可行的是____(填字母)
A.增大压强 B.升高温度 C.保持容积不变充入氩气
工业生产中为提高丙烯的产率,还常在恒压时向原料气中掺入水蒸气,其目的是_____。
③1×104Pa时,图中表示丙烷和丙烯体积分数的曲线分别是___、____(填标号)
④1×104Pa、500℃时,该反应的平衡常数Kp=____Pa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,计算结果保留两位有效数字)
(3)利用CO2的弱氧化性,科学家开发了丙烷氧化脱氢制丙烯的新工艺,该工艺可采用铬的氧化物作催化剂,已知C3H8+CO2(g) C3H6(g)+CO(g)+H2O(l),该工艺可以有效消除催化剂表面的积炭,维持催化剂的活性,其原因是____,相对于丙烷直接裂解脱氢制丙烯的缺点是_____。
C3H6(g)+CO(g)+H2O(l),该工艺可以有效消除催化剂表面的积炭,维持催化剂的活性,其原因是____,相对于丙烷直接裂解脱氢制丙烯的缺点是_____。