题目内容
【题目】工厂化验员检验某含有KBrO3、KBr及惰性物的样品。化验员称取了该固体样品1.000 g,加水溶解后配成100 mL溶液X。
Ⅰ. 取25.00 mL溶液X,加入稀硫酸,然后用Na2SO3将BrO![]() 还原为Br-;
还原为Br-;
Ⅱ. 去除过量的SO![]() 后调至中性;
后调至中性;
Ⅲ. 加入K2CrO4作指示剂,用0.100 0 mol·L-1AgNO3标准溶液滴定Br-至终点,消耗 AgNO3标准溶液11.25 mL;
Ⅳ. 另取25.00 mL溶液X,酸化后加热,再用碱液调至中性,测定过剩Br-,消耗上述AgNO3标准溶液3.75 mL。
已知:①25 ℃时,Ag2CrO4(砖红色)的Ksp=1.12×10-12,AgBr(浅黄色)的Ksp=5.0×
10-15;
②Ⅳ中酸化时发生反应:BrO![]() +5Br-+6H+=== 3Br2+3H2O
+5Br-+6H+=== 3Br2+3H2O
请回答:
(1)步骤Ⅰ中,反应的离子方程式为________________________________。
(2)步骤Ⅲ中,滴定终点的现象为_____________________________________________。
(3)步骤Ⅳ中,加热的目的是________________________。
(4)计算试样中KBrO3质量分数。(写出计算过程,结果保留3位有效数字)_______________
【答案】3SO32-+BrO3-===Br-+3SO42- 当滴入最后一滴AgNO3溶液时,产生砖红色沉淀 除去溶解在溶液中的Br2(或使Br2挥发) w(KBrO3)= 8.35% 第一次所取25.00 mL溶液中:n(Br-)总=n(AgBr)=0.100 0 mol·L-1×11.25×10-3 L=1.125×10-3 mol所以,n(BrO![]() )+n(Br-)=n(Br-)总=1.125×10-3 mol (1分)第二次所取25.00 mL溶液,加酸反应后:n(Br-)余=0.100 0mol·L-1× 3.75×10-3L=3.75×10-4 mol 由步骤Ⅳ可知:BrO
)+n(Br-)=n(Br-)总=1.125×10-3 mol (1分)第二次所取25.00 mL溶液,加酸反应后:n(Br-)余=0.100 0mol·L-1× 3.75×10-3L=3.75×10-4 mol 由步骤Ⅳ可知:BrO![]() ~5Br-所以,n(BrO
~5Br-所以,n(BrO![]() )=
)=![]() ×[n(Br-)总-n(Br-)余]=
×[n(Br-)总-n(Br-)余]=![]() ×(1.125×10-3 mol-3.75×10-4 mol)=1.25×10-4 mol由1 g样品配成100 mL溶液,且每次实验取的是25 mL所以,w(KBrO3)=
×(1.125×10-3 mol-3.75×10-4 mol)=1.25×10-4 mol由1 g样品配成100 mL溶液,且每次实验取的是25 mL所以,w(KBrO3)=![]() ×100%=8.35%
×100%=8.35%
【解析】
(1) 步骤Ⅰ中,“加入稀硫酸,然后用Na2SO3将BrO![]() 还原为Br-”,SO32-是还原剂,其氧化产物是SO42-,BrO3-是氧化剂,还原产物是Br-,再根据化合价升降守恒和元素守恒配平其离子方程式。
还原为Br-”,SO32-是还原剂,其氧化产物是SO42-,BrO3-是氧化剂,还原产物是Br-,再根据化合价升降守恒和元素守恒配平其离子方程式。
(2) 步骤Ⅲ中,待测溶液中的Br-与标准溶液反应:Ag++Br-=AgBr↓生成浅黄色沉淀,当Br-耗尽,再多一滴AgNO3标准溶液即发生2Ag++CrO42-=Ag2CrO4↓,产生砖红色沉淀,即表示达到滴定终点。
(3) 步骤Ⅳ中,酸化时使KBrO3与KBr反应:BrO![]() +5Br-+6H+=== 3Br2+3H2O,再测定剩余的Br-,而溶液中溶解的Br2会干扰Br-的测定,通过加热让Br2挥发而除去。
+5Br-+6H+=== 3Br2+3H2O,再测定剩余的Br-,而溶液中溶解的Br2会干扰Br-的测定,通过加热让Br2挥发而除去。
(4)由步骤III消耗AgNO3标准溶液11.25mL可计算25.00mL溶液X中KBrO3和KBr中溴元素总物质的量;由反应式BrO![]() +5Br-+6H+=== 3Br2+3H2O可知,其中BrO3-与参加反应的Br-的物质的量之比为1:5,再由步骤IV的数据计算25.00mL溶液X中KBrO3的物质的量。
+5Br-+6H+=== 3Br2+3H2O可知,其中BrO3-与参加反应的Br-的物质的量之比为1:5,再由步骤IV的数据计算25.00mL溶液X中KBrO3的物质的量。
(1) 步骤Ⅰ中,“加入稀硫酸,然后用Na2SO3将BrO![]() 还原为Br-”,SO32-是还原剂,其氧化产物是SO42-,BrO3-是氧化剂,还原产物是Br-,根据化合价升降守恒和元素守恒配平,其反应的离子方程式为:3SO32-+BrO3-===Br-+3SO42-。
还原为Br-”,SO32-是还原剂,其氧化产物是SO42-,BrO3-是氧化剂,还原产物是Br-,根据化合价升降守恒和元素守恒配平,其反应的离子方程式为:3SO32-+BrO3-===Br-+3SO42-。
(2)步骤Ⅲ中,待测溶液中的Br-与标准溶液反应:Ag++Br-=AgBr↓,生成浅黄色沉淀,当Br-耗尽,再多一滴AgNO3标准溶液即发生2Ag++CrO42-=Ag2CrO4↓,产生砖红色沉淀,即表示达到滴定终点。滴定终点的现象为:当滴入最后一滴AgNO3溶液时,产生砖红色沉淀。
(3) 步骤Ⅳ中,酸化时使KBrO3与KBr反应:BrO![]() +5Br-+6H+=== 3Br2+3H2O,再测定剩余的Br-,而溶液中溶解的Br2会干扰Br-的测定,通过加热让Br2挥发而除去。所以加热的目的是除去溶解在溶液中的Br2(或使Br2挥发)。
+5Br-+6H+=== 3Br2+3H2O,再测定剩余的Br-,而溶液中溶解的Br2会干扰Br-的测定,通过加热让Br2挥发而除去。所以加热的目的是除去溶解在溶液中的Br2(或使Br2挥发)。
(4)根据反应方程式Ag++Br-=AgBr↓,25.00mL溶液X中KBrO3和KBr中的溴元素总物质的量=n(Br-)总=n(AgNO3)=0.100 0 mol·L-1×11.25×10-3 L=1.125×10-3 mol,即n(BrO![]() )+n(Br-)=n(Br-)总=1.125×10-3 mol。由步骤IV可知,第二次取25.00mL样品溶液加酸反应完全后剩余Br-的物质的量n(Br-)余=0.100 0mol·L-1× 3.75×10-3L=3.75×10-4 mol。由反应方程式BrO
)+n(Br-)=n(Br-)总=1.125×10-3 mol。由步骤IV可知,第二次取25.00mL样品溶液加酸反应完全后剩余Br-的物质的量n(Br-)余=0.100 0mol·L-1× 3.75×10-3L=3.75×10-4 mol。由反应方程式BrO![]() +5Br-+6H+=== 3Br2+3H2O可知,其中BrO3-与参加反应的Br-的物质的量之比为1:5,所以25.00mL溶液X中含BrO3-的物质的量n(BrO
+5Br-+6H+=== 3Br2+3H2O可知,其中BrO3-与参加反应的Br-的物质的量之比为1:5,所以25.00mL溶液X中含BrO3-的物质的量n(BrO![]() )=
)=![]() ×[n(Br-)总-n(Br-)余]=
×[n(Br-)总-n(Br-)余]=![]() ×(1.125×10-3 mol-3.75×10-4 mol)=1.25×10-4 mol。由1 g样品配成100 mL溶液,且每次实验取的是25 mL,所以试样中KBrO3的质量分数w(KBrO3)=
×(1.125×10-3 mol-3.75×10-4 mol)=1.25×10-4 mol。由1 g样品配成100 mL溶液,且每次实验取的是25 mL,所以试样中KBrO3的质量分数w(KBrO3)=![]() ×100%=8.35%。
×100%=8.35%。

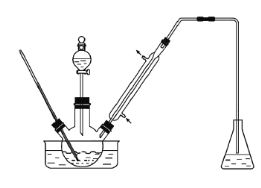
【题目】实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图,相关物质的沸点见附表)。
物质 | 沸点/℃ | 物质 | 沸点/℃ |
溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
苯甲醛 | 179 | 间溴苯甲醛 | 229 |
其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。
(1) 实验装置中冷凝管的主要作用是___________________。
(2) 步骤1所加入的物质中,有一种物质是催化剂,其化学式为__________________
(3) 写出由苯甲醛制取间溴苯甲醛的化学方程式_____________________________________________________
(4) 为防止污染环境,锥形瓶中盛装的溶液应该是______________________________