题目内容
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向蔗糖中加入浓硫酸,搅拌得黑色海绵状固体,并放出刺激性气味气体 | 浓硫酸仅体现吸水性和脱水性 |
B | 向蓝色石蕊试纸上滴加新制氯水,试纸边缘呈红色,中间为白色 | 氯水既有酸性又有还原性 |
C | 卤代烃Y与NaOH溶液共热后,加入足量稀硝酸,再滴加AgNO3溶液,产生白色沉淀 | 卤代烃Y中含有氯原子 |
D | 取5 mL 0.1 mol·L-1KI溶液,加入1 mL 0.1 mol·L-1FeCl3溶液,萃取分液后,向水层滴入KSCN溶液,溶液变成血红色 | Fe3+与I-所发生的反应为可逆反应 |
A. A B. B C. C D. D
【答案】CD
【解析】
A. 蔗糖中加入浓硫酸得黑色的炭,说明浓硫酸具有脱水性,放出的刺激性气味气体是SO2,说明浓硫酸具有强氧化性:C+2H2SO4(浓)![]() CO2↑+SO2↑+2H2O,A项错误;
CO2↑+SO2↑+2H2O,A项错误;
B. 试纸边缘呈红色,说明氯水显酸性;液滴中间为白色,说明液滴中间的HClO浓度大,HClO漂白了试纸,说明氯水具有漂白性。B项错误;
C.卤代烃在NaOH溶液中发生水解反应R-X+NaOH![]() R-OH+NaX,加入足量稀硝酸中和过量的NaOH后,再加入AgNO3溶液Ag++X-=AgX↓生成的白色沉淀是AgCl,所以Y为氯代烃,C项正确;
R-OH+NaX,加入足量稀硝酸中和过量的NaOH后,再加入AgNO3溶液Ag++X-=AgX↓生成的白色沉淀是AgCl,所以Y为氯代烃,C项正确;
D.有反应2I-+2Fe3+=I2+2Fe2+, 5 mL 0.1 mol·L-1KI溶液与1 mL 0.1 mol·L-1FeCl3溶液中物质的量之比n(KI):n(FeCl3)≈5:1,说明KI过量,如果该反应是不可逆反应,则混合后溶液中没有Fe3+,萃取分液后的水层中加入KSCN溶液,溶液不会变红,但事实上溶液变红,所以Fe3+与I-所发生的反应为可逆反应,D项正确;答案选CD。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图,相关物质的沸点见附表)。
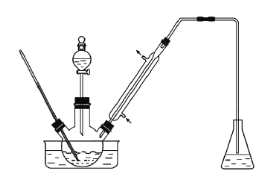
物质 | 沸点/℃ | 物质 | 沸点/℃ |
溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
苯甲醛 | 179 | 间溴苯甲醛 | 229 |
其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。
(1) 实验装置中冷凝管的主要作用是___________________。
(2) 步骤1所加入的物质中,有一种物质是催化剂,其化学式为__________________
(3) 写出由苯甲醛制取间溴苯甲醛的化学方程式_____________________________________________________
(4) 为防止污染环境,锥形瓶中盛装的溶液应该是______________________________
【题目】在不同温度下,向V L密闭容器中加入0.5 mol NO和0.5 mol活性炭,发生反应:
2NO(g)+C(s)![]() N2(g)+CO2(g) △H= —Q kJ·mol-1(Q>0),达到平衡时的数据如下:
N2(g)+CO2(g) △H= —Q kJ·mol-1(Q>0),达到平衡时的数据如下:
温度/℃ | n (C)/mol | n(CO2)/mol |
T1 | 0.15 | |
T2 | 0.375 |
下列有关说法正确的是
A. 由上述信息可推知:T1 > T2
B. T2℃时,若反应达平衡后再缩小容器的体积,c (N2):c (NO)增大
C. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率增大
D. T1℃时,该反应的平衡常数![]()




