题目内容
【题目】镍及其化合物在工农业生产中有着广泛应用,回答下列问题:
![]() 基态镍原子的价电子排布式为_________;元素镍的第二电离能比铜的小,其原因为_________________。
基态镍原子的价电子排布式为_________;元素镍的第二电离能比铜的小,其原因为_________________。
![]() 的检验可通过如下反应进行:
的检验可通过如下反应进行:
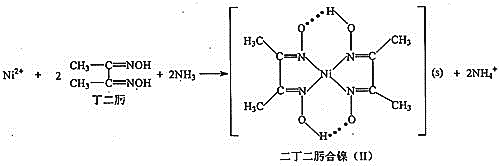
![]() 丁二肟中碳原子的杂化轨道类型为___________。
丁二肟中碳原子的杂化轨道类型为___________。
![]() 二丁二肟合镍
二丁二肟合镍![]() Ⅱ
Ⅱ![]() 中存在的作用力有_________
中存在的作用力有_________![]() 填选项字母
填选项字母![]() 。
。
A.![]() 键
键 ![]() 键
键 ![]() 配位健
配位健 ![]() 氢键
氢键
![]() 四羰基镍
四羰基镍![]() 为无色挥发性剧毒液体。熔点
为无色挥发性剧毒液体。熔点![]() ,沸点
,沸点![]() 。不溶于水,易溶于乙醇等有机溶剂,呈四面体构型。四羰基镍的晶体类型是__________。
。不溶于水,易溶于乙醇等有机溶剂,呈四面体构型。四羰基镍的晶体类型是__________。![]() 可通过如下反应合成:
可通过如下反应合成:![]() 。反应中涉及所有元素的电负性由大到小的顺序为______________:与
。反应中涉及所有元素的电负性由大到小的顺序为______________:与![]() 互为等电子体的分子有__________
互为等电子体的分子有__________![]() 任写1种
任写1种![]() 。
。
![]() 和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在中国已实现了产业化。该合金的晶胞结构如图所示。
和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在中国已实现了产业化。该合金的晶胞结构如图所示。
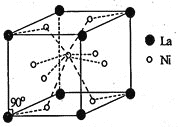
![]() 该晶体的化学式为____________。
该晶体的化学式为____________。
![]() 已知该晶体的摩尔质量为
已知该晶体的摩尔质量为![]() ,密度为
,密度为![]() 。设
。设![]() 为阿伏加德罗常数的值,则该晶胞的体积是___________
为阿伏加德罗常数的值,则该晶胞的体积是___________![]() 用含M、d、
用含M、d、![]() 的代数式表示
的代数式表示![]() 。
。
【答案】![]() 铜失去的是全充满的
铜失去的是全充满的![]() 电子,镍失去的是
电子,镍失去的是![]() 电子
电子 ![]() 、
、![]()
![]() 分子晶体
分子晶体 ![]()
![]() 或
或![]() 或
或![]()
![]() 或
或![]()
![]()
【解析】
![]() 镍是28号元素,原子核外有28个电子,根据构造原理书写基态镍原子的价电子排布式;铜失去的是全充满的
镍是28号元素,原子核外有28个电子,根据构造原理书写基态镍原子的价电子排布式;铜失去的是全充满的![]() 电子结构,相对稳定;
电子结构,相对稳定;
![]() 碳氮之间是双键,双键是由一个σ键和一个π键构成;镍原子有空轨道,氮原子有孤电子对,因此二者形成配位键;丁二酮肟中甲基中的碳原子都是单键,在与氮相连的碳上有碳氮双键;d区的元素为除了第IB、IIB族元素外的过渡元素,以此解答该题;
碳氮之间是双键,双键是由一个σ键和一个π键构成;镍原子有空轨道,氮原子有孤电子对,因此二者形成配位键;丁二酮肟中甲基中的碳原子都是单键,在与氮相连的碳上有碳氮双键;d区的元素为除了第IB、IIB族元素外的过渡元素,以此解答该题;
![]() 根据熔沸点判断晶体类型;元素的非金属性越强,电负性越大;根据等电子体理论写出与
根据熔沸点判断晶体类型;元素的非金属性越强,电负性越大;根据等电子体理论写出与![]() 互为等电子体的分子;
互为等电子体的分子;
![]() 根据均摊法计算晶胞中实际含有的原子个数,确定化学式;
根据均摊法计算晶胞中实际含有的原子个数,确定化学式;
![]() 根据一个晶胞的质量m=ρv计算。
根据一个晶胞的质量m=ρv计算。
![]() 镍是28号元素,原子核外有28个电子,根据构造原理基态镍原子的核外电子排布式为[Ar]3d84s2,则基态镍原子的价电子排布式为:
镍是28号元素,原子核外有28个电子,根据构造原理基态镍原子的核外电子排布式为[Ar]3d84s2,则基态镍原子的价电子排布式为:![]() ;元素镍的第二电离能比铜的小,其原因为:铜失去的是全充满的
;元素镍的第二电离能比铜的小,其原因为:铜失去的是全充满的![]() 电子,镍失去的是
电子,镍失去的是![]() 电子;
电子;
![]()
![]() 丁二酮肟中甲基中的碳原子都是单键,在与氮相连的碳上有碳氮双键,因此杂化类型是
丁二酮肟中甲基中的碳原子都是单键,在与氮相连的碳上有碳氮双键,因此杂化类型是![]() 和
和![]() 杂化;
杂化;
![]() 由结构简式可知分子中存在配位键,含有
由结构简式可知分子中存在配位键,含有![]() 键,则含有
键,则含有![]() 键、
键、![]() 键、氧氢之间除共价键外还可存在氢键,故答案为:ABCD;
键、氧氢之间除共价键外还可存在氢键,故答案为:ABCD;
![]() 四羰基镍
四羰基镍![]() 为无色挥发性剧毒液体。熔点
为无色挥发性剧毒液体。熔点![]() ,沸点
,沸点![]() 熔沸点较低,为分子晶体;
熔沸点较低,为分子晶体;![]() 可通过如下反应合成:
可通过如下反应合成:![]() 。反应中涉及所有元素的电负性由大到小的顺序为:
。反应中涉及所有元素的电负性由大到小的顺序为:![]() 或
或![]() ;与
;与![]() 互为等电子体的分子有:
互为等电子体的分子有:![]() 或
或![]() 或
或![]() ;
;
![]() 晶胞中心有一个镍原子,其他8个镍原子都在晶胞面上,镧原子都在晶胞顶点,所以晶胞实际含有的镍原子数目
晶胞中心有一个镍原子,其他8个镍原子都在晶胞面上,镧原子都在晶胞顶点,所以晶胞实际含有的镍原子数目![]()
![]()
![]() ,晶胞实际含有的镧原子数目
,晶胞实际含有的镧原子数目![]()
![]()
![]() ,所以晶体的化学式LaNi
,所以晶体的化学式LaNi![]() ;
;
![]() 一个晶胞的质量
一个晶胞的质量![]() g,该晶胞的体积=
g,该晶胞的体积= ![]() =
=![]() cm
cm![]() 。
。

【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:① 2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1;②4NO2(g)+2NaCl(s)
NaNO3(s)+ClNO(g) K1;②4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2;③2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g) K2;③2NO(g)+Cl2(g)![]() 2ClNO(g) K3,则K1、K2、K3之间的关系为K3=_______________(用K1和K2表示);
2ClNO(g) K3,则K1、K2、K3之间的关系为K3=_______________(用K1和K2表示);
(2)已知几种化学键的键能数据如下表:(亚硝酰氯的结构为Cl—N==O)
化学键 | N≡O | Cl-Cl | Cl-N | N==O |
键能/(kJ·mol-1) | 630 | 243 | a | 607 |
则2NO(g)+Cl2(g)![]() 2ClNO(g)的反应的 △H和a的关系为 △H = ___kJ·mol-1。
2ClNO(g)的反应的 △H和a的关系为 △H = ___kJ·mol-1。
(3)300℃时,2NO(g)+Cl2 (g)![]() 2ClNO(g)的正反应速率表达式为v正 = k·cn (ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为v正 = k·cn (ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/(mol·L-1) | v/(mol·L-1·s-l) |
① | 0. 30 | 3. 60×10-9 |
② | 0. 60 | 1. 44×10-8 |
③ | 0. 90 | 3. 24×10-8 |
n = ___;k = ____。
(4)若向绝热恒容密闭容器中充入物质的量之比为2 : 1的NO和Cl2进行反应2NO(g)+Cl2(g)![]() 2ClNO(g),能判断反应已达到化学平衡状态的是__(填标号)。
2ClNO(g),能判断反应已达到化学平衡状态的是__(填标号)。
a.容器中的压强不变 b.2v正(NO) = v逆(Cl2)c.气体的平均相对分子质量保持不变 d.该反应平衡常数保持不变e.NO和Cl2的体积比保持不变
(5)25℃时,向体积为2 L且带气压计的恒容密闭容器中通入0.08 mol NO和0.04 mol Cl2发生反应:2NO(g)+Cl2 (g)![]() 2ClNO(g)△H。
2ClNO(g)△H。
①若反应起始和平衡时温度相同,测得反应过程中压强(p)随时间(t)的变化如图甲曲线a所示,则 △H __(填“>”“<”或“不确定”)0;若其他条件相同,仅改变某一条件时,测得其压强(p)随时间(t)的变化如图甲曲线b所示,则改变的条件是______。
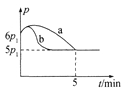
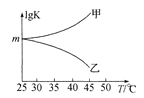
②图是甲、乙同学描绘上述反应平衡常数的对数值(lg K)与温度的变化关系,其中正确的曲线是____(填“甲”或“乙”),m值为_____。
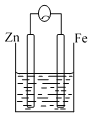
【题目】(1)根据氯化铁溶液回答下列问题:
①向FeCl3溶液中加入少量NaHCO3。产生的现象为___。用离子方程式表示其原因___。
②不断加热FeCl3溶液蒸干其水分并灼烧,得到的固体是___。
③在配制FeCl3溶液时,为防止溶液变浑浊,应加入___。
(2)利用反应Cu+H2O2+H2SO4=CuSO4+2H2O设计一个原电池,回答下列问题:
①负极材料为___;正极反应式为___。
②反应过程中SO![]() 向____极移动。
向____极移动。
③当电路中转移0.1mol电子时,电解液质量(不含电极)增加了___克。
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
①物质的量浓度均为0.1molL-1的四种溶液:pH由小到大排列的顺序是__(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②常温下,0.1molL-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是___(填字母)
A.c(H+) B.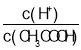 C.c(H+)c(OH-) D.
C.c(H+)c(OH-) D.![]() E.
E.![]()
③写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:____。
④25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=____(填准确数值)。
⑤标准状况下,将1.12LCO2通入100mL1molL-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:c(OH-)=2c(H2CO3)+____。
【题目】已知硫代硫酸钠在酸性条件下会发生反应:![]() ,下表中的两种溶液混合,出现浑浊的先后顺序是( )
,下表中的两种溶液混合,出现浑浊的先后顺序是( )
组号 | 两种溶液的温度 |
| 稀硫酸的体积、浓度 |
① | 15℃ | 10mL0.1mol/L | 50mL0.05mol/L |
② | 15℃ | 10mL0.05mol/L | 10mL0.1mol/L |
③ | 25℃ | 10mL0.05mol/L | 10mL0.1mol/L |
④ | 25℃ | 10mL0.1mol/L | 30mL0.07mol/L |
A.④①②③B.③④②①
C.④③②①D.④③①②