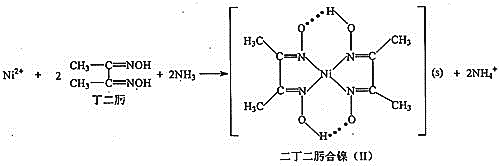
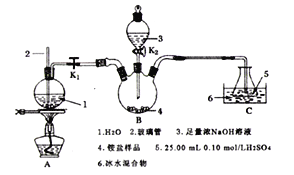
题目内容
【题目】某研究小组为制备消毒液(主要成分是NaClO)设计了下列装置,并查阅下列资料:在温度较高情况下卤素单质和碱溶液能发生如下反应:3X2+6OH-![]() 5X-+XO3-+3H2O
5X-+XO3-+3H2O
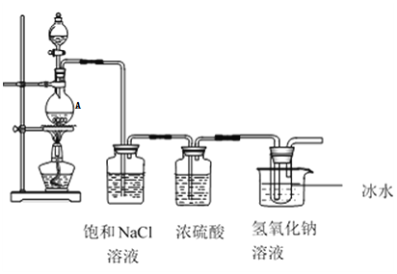
回答下列问题:
(1)仪器 A的名称为_______发生装置中反应的离子方程式为:____。
(2)饱和NaCl溶液的作用是______,能否省去盛有浓硫酸的洗气瓶_____,理由是______
(3)能否省去冰水冷却________,用化学方程式表示原因是:_______,大试管内发生反应的离子方程式为________。
【答案】圆底烧瓶(或烧瓶) ![]() 除去Cl2中的HCl气体 能 最后一个装置Cl2和NaOH溶液反应制取NaClO,NaOH溶液本来就有水,所以反应之前不用除水 不能 3Cl2+6OH-
除去Cl2中的HCl气体 能 最后一个装置Cl2和NaOH溶液反应制取NaClO,NaOH溶液本来就有水,所以反应之前不用除水 不能 3Cl2+6OH-![]() 5Cl-+ClO3-+3H2O Cl2+2OH-+=ClO-+Cl-+H2O
5Cl-+ClO3-+3H2O Cl2+2OH-+=ClO-+Cl-+H2O
【解析】
氯气和氢氧化钠反应生成氯化钠和次氯酸钠和水,所以最左边的装置是用MnO2和浓HCl在加热条件下制取氯气的,由于浓HCl易挥发,所以氯气中混有HCl,常用饱和NaCl溶液除去,此时氯气中含有水蒸气,若是探究氯气的性质,浓硫酸不能少,但是本题最后一个装置是和NaOH溶液反应制取NaClO,NaOH溶液本来就有水,所以反应之前不用除水,无需浓硫酸,据此回答。
(1)由图可知,A为圆底烧瓶(或烧瓶),A中发生的反应为:![]() ,故答案为:圆底烧瓶(或烧瓶);
,故答案为:圆底烧瓶(或烧瓶);![]() ;
;
(2) 饱和NaCl溶液的作用是除去Cl2中的HCl气体,若是探究氯气的性质,浓硫酸不能少,但是本题最后一个装置是Cl2和NaOH溶液反应制取NaClO,NaOH溶液本来就有水,所以反应之前不用除水,无需浓硫酸,故答案为:除去Cl2中的HCl气体;能;最后一个装置Cl2和NaOH溶液反应制取NaClO,NaOH溶液本来就有水,所以反应之前不用除水;
(3) 由题意可知,氯气在高温下和氢氧化钠发生副反应:3Cl2+6OH-![]() 5Cl-+ClO3-+3H2O,所以不能省去冰水浴,防止溶液温度升高而发生副反应,大试管用来制取NaClO,离子方程式为:Cl2+2OH-+=ClO-+Cl-+H2O,故答案为:不能;3Cl2+6OH-
5Cl-+ClO3-+3H2O,所以不能省去冰水浴,防止溶液温度升高而发生副反应,大试管用来制取NaClO,离子方程式为:Cl2+2OH-+=ClO-+Cl-+H2O,故答案为:不能;3Cl2+6OH-![]() 5Cl-+ClO3-+3H2O;Cl2+2OH-+=ClO-+Cl-+H2O。
5Cl-+ClO3-+3H2O;Cl2+2OH-+=ClO-+Cl-+H2O。

 阅读快车系列答案
阅读快车系列答案【题目】现有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素的核内质子数之和为56,在元素周期表中的位置如图所示,1 mol E的单质可与足量酸反应,能产生33.6 L H2(在标准状况下);E的阳离子与A的阴离子核外电子层结构相同。
A | ||
B | C | D |
回答下列问题:
(1)写出下列元素名称A__________,B___________,E____________
(2)C的简单离子结构示意图为_____________
(3)B单质在A单质中燃烧,反应现象是__________________________________,生成物的化学式为___________
(4)A与E形成的化合物的化学式为__________,它的性质决定了它在物质的分类中应属于__________________
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液至过量,此过程中观察到的现象是_______________________,写出有关化学反应方程式______________________________。