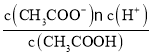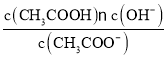题目内容
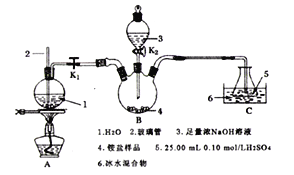
【题目】CoC2O4是制备金属钴的原料。利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如图:
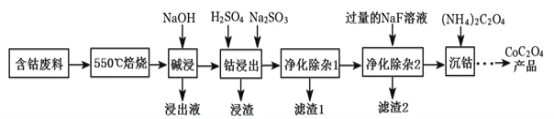
(1)“550℃煅烧”的目的是____。
(2)“浸出液”的主要成分是___。
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为___。
(4)“净化除杂1”过程中,如何检验该杂质__(用离子方程式表示),现象为__:需在40~50℃加入H2O2溶液,其原因是__,目的是__(用离子方程式表示);再升温至80~85℃,加入Na2CO3溶液,调pH至5,“滤渣I”的主要成分是__。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l0-5 mol/L,则滤液中c(Mg2+)为___mol/L。[已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10]
【答案】除去碳和有机物 Na AlO2 2Co3++SO![]() +H2O=2Co2++SO
+H2O=2Co2++SO![]() +2H+ 3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ 有蓝色沉淀产生 H2O2作氧化剂的还原产物为H2O无污染,温度过高会导致H2O2分解 3Fe2++2H++H2O2=3Fe3++2H2O Fe(OH)3 7.0×10-6
+2H+ 3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ 有蓝色沉淀产生 H2O2作氧化剂的还原产物为H2O无污染,温度过高会导致H2O2分解 3Fe2++2H++H2O2=3Fe3++2H2O Fe(OH)3 7.0×10-6
【解析】
550℃焙烧含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)除去碳和有机物,加入氢氧化钠溶液,其中Al2O3溶解生成Na AlO2,Co2O3、Fe2O3、MgO不溶,过滤,CaO与水反应生成氢氧化钙,则浸出液的主要为Na AlO2,向过滤得到的固体加入稀硫酸和亚硫酸钠,Na2SO3将Co3+、Fe3+还原为Co2+、Fe2+,可得CoCl2、FeCl2、MgCl2、CaCl2,在40~50℃加入H2O2,氧化Fe2+氧化为Fe3+,再升温至80~85℃,加入Na2CO3调pH至5,可得到Fe(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MgCl2、CaCl2,用NaF溶液除去钙、镁,过滤后,滤液中主要含有CoCl2,加入草酸铵溶液得到草酸钴。
(1)碳和有机物可通过焙烧除去,含钴废料“550℃焙烧”可以除去碳和有机物,故答案为:除去碳和有机物;
(2)550℃焙烧含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)除去碳和有机物,加入氢氧化钠溶液,Al2O3溶解,氧化铝可以和氢氧化钠溶液之间反应生成偏铝酸钠:Al2O3+2 NaOH=2 NaAlO2+H2O,CaO与水反应生成氢氧化钙,所以浸出液的主要成分为Na AlO2(Na AlO2和NaOH、Ca(OH)2);故答案为:Na AlO2;
(3)“钴浸出”过程中Co3+转化为Co2+,则Na2SO3将Co3+还原为Co2+,自身被氧化为硫酸钠,发生的反应为:2Co3++SO![]() +H2O=2Co2++SO
+H2O=2Co2++SO![]() +2H+;故答案为:2Co3++SO
+2H+;故答案为:2Co3++SO![]() +H2O=2Co2++SO
+H2O=2Co2++SO![]() +2H+;
+2H+;
(4)“净化除杂1”过程中,向过滤得到的固体加入稀硫酸和亚硫酸钠,Na2SO3将Co3+、Fe3+还原为Co2+、Fe2+,用K3[Fe(CN)6]检验Fe2+:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓,现象为有蓝色沉淀产生:需在40~0℃加入H2O2溶液,其原因是H2O2作氧化剂的还原产物为H2O无污染,温度过高会导致H2O2分解,目的是氧化Fe2+氧化为Fe3+,3Fe2++2H++H2O2=3Fe3++2H2O;再升温至80~85℃,加入Na2CO3溶液,调pH至5,铁离子能与碳酸根离子发生双水解生成氢氧化铁和二氧化碳,水解的离子方程式为:2Fe3++3CO![]() +3H2O=2Fe(OH)3↓+3CO2↑,“滤渣I”的主要成分是Fe(OH)3。故答案为:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓;有蓝色沉淀产生;H2O2作氧化剂的还原产物为H2O无污染,温度过高会导致H2O2分解;3Fe2++2H++H2O2=3Fe3++2H2O;Fe(OH)3;
+3H2O=2Fe(OH)3↓+3CO2↑,“滤渣I”的主要成分是Fe(OH)3。故答案为:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓;有蓝色沉淀产生;H2O2作氧化剂的还原产物为H2O无污染,温度过高会导致H2O2分解;3Fe2++2H++H2O2=3Fe3++2H2O;Fe(OH)3;
(5)由溶度积可知,滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为CaF2、MgF2沉淀,根据溶度积计算,c(Mg2+):c(Ca2+)=Ksp(MgF2):Ksp(CaF2)=7.35×10-11:1.05×10-10=0.7,若所得滤液中c(Ca2+)=1.0×10-5 mol·L-1,则滤液中c(Mg2+)=7.0×10-6mol·L-1,故答案为:7.0×10-6 mol·L-1。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案【题目】溶液X中含有右表离子中的某5种,且其浓度均为![]() 不考虑水的电离与离子水解
不考虑水的电离与离子水解![]() 向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化.下列叙述不正确的是( )
向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化.下列叙述不正确的是( )
阳离子 | 阴离子 |
Fe Fe |
|
A.X溶液中不可能含有![]() 或
或![]()
B.生成无色气体的离子方程式为:![]()
C.根据电荷守恒,原溶液中一定含![]()
D.X溶液中一定含3种阳离子、2种阴离子