题目内容
16.化学反应是旧化学键断裂和新化学键形成的过程.氢气与氧气的反应中,破坏lmol氢氢键消耗的能量为Q1kJ、破坏1mol氧氧键消耗的能量为Q2kJ、形成lmol氢氧键释放的能量为Q3kJ.下列关系中正确的是( )| A. | Ql+Q2<Q3 | B. | Ql+Q2>2Q3 | C. | 2Ql+Q2<4Q3 | D. | 2Ql+Q2>4Q3 |
分析 化学反应中旧键断裂需要吸收能量,新键形成需要放出能量,化学反应中的反应热△H=反应物总键能-生成物总键能,H-H键的键能为436kJ/mol,O═O键的键能为498kJ/mol,注意氢气在氧气中燃烧,反应热△H<0,每摩尔H2O中含有2molH-O键,据此计算.
解答 解:破坏1molH-H消耗的能量为Q1kJ,则H-H键能为Q1kJ/mol,破坏1molO═O键消耗的能量为Q2kJ,则O═O键键能为Q2kJ/mol,
形成lmol氢氧键释放的能量为Q3kJ,每摩尔H2O中含有2molH-O键,
对于反应2H2(g)+O2(g)═2H2O(l)反应热△H=反应物的总键能-生成物的总键能,
故:反应热△H=2Q1kJ/mol+Q2kJ/mol-4×Q3kJ/mol=(2Q1+Q2-4Q3)KJ/mol,
由于氢气在氧气中燃烧,反应热△H<0,即(2Q1+Q2-4Q3)<0,所以2Q1+Q2<4Q3,
故选C.
点评 本题考查反应热的计算,题目难度不大,注意从物质能量、键能角度理解反应热,明确反应热的焓变△H=反应物总键能-生成物总键能及焓变的正负与吸收、放热热量的关系.

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
6.由于发生化学反应而使溴水褪色的一组物质是( )
①甲苯 ②聚乙烯 ③四氯化碳 ④2-丁炔 ⑤(CH3)2C=CHCH3.
①甲苯 ②聚乙烯 ③四氯化碳 ④2-丁炔 ⑤(CH3)2C=CHCH3.
| A. | ①④ | B. | ②④⑤ | C. | ④⑤ | D. | ①③④⑤ |
7.某课外小组同学通过实验发现钾和钠的化学性质相似.下列解释最合理的是( )
| A. | 都属于金属元素 | B. | 原子半径相差不大 | ||
| C. | 原子的电子层数相接近 | D. | 原子的最外层电子数相同 |
11.五种短周期元素的某些性质如表所示(其中只有W、Y、Z为同周期元素)
下列说法正确的是( )
| 元素代号 | X | W | Y | Z | Q |
| 原子半径(×10-12m) | 37 | 64 | 66 | 70 | 154 |
| 主要化合价 | +1 | -1 | -2 | +5、-3 | +1 |
| A. | 由Q与Y形成的化合物中只存在离子键 | |
| B. | Z与X之间形成的化合物具有还原性 | |
| C. | 由X、Y、Z三种元素形成的化合物,一定是共价化合物 | |
| D. | Y与W形成的化合物中,Y显负价 |
5.门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确.根据元素周期律,下列有关X性质的描述中错误的是( )
| A. | X单质不易与水反应 | B. | XO2可被碳或氢气还原为X | ||
| C. | XH4的稳定性比SiH4的高 | D. | XCl4的沸点比SiCl4的高 |
6.下列说法正确的是 ( )
| A. | 紫色石蕊试液中通入二氧化硫,溶液先变红后褪色 | |
| B. | 将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化 | |
| C. | 硫粉在过量的纯氧中燃烧可以生成大量的SO3 | |
| D. | 富含硫黄的矿物在工业上可用于制造硫酸 |
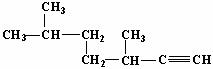 的名称为3,6-二甲基-1-庚炔;
的名称为3,6-二甲基-1-庚炔;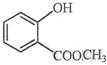 中含氧官能团的名称为羟基、酯基.
中含氧官能团的名称为羟基、酯基.