题目内容
12.氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制.常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等.请写出氢气换成甲烷时所构成的甲烷燃料电池中的电极反应式(KOH溶液):负极CH4+10OH--8e-=CO32-+7H2O正极O2+2H2O+4e-=4OH-,此时电池内总的反应式:CH4+2O2+2OH-=CO32-+3H2O.
分析 甲烷燃料碱性电池中,通入甲烷的电极是负极,负极上甲烷失电子发生氧化反应,正极上氧气得电子发生还原反应,在得失电子相同条件下,将正负极电极反应式相加即得电池反应式,据此分析解答.
解答 解:甲烷燃料碱性电池中,通入甲烷的电极是负极,负极上甲烷失电子发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O;正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-;在得失电子相同条件下,将正负极电极反应式相加即得电池反应式,电池反应式为CH4+2O2+2OH-=CO32-+3H2O,
故答案为:CH4+10OH--8e-=CO32-+7H2O;O2+2H2O+4e-=4OH-;CH4+2O2+2OH-=CO32-+3H2O.
点评 本题考查电池反应式及电极反应式的书写,为高频考点,明确正负极上发生的反应及反应产物是解本题关键,注意结合电解质溶液酸碱性书写,题目难度中等.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
2.在一个密闭容器中盛有N2和H2,它们的起始浓度分别是1.8mol/L和5.4mol/L,在一定的条件下它们反应生成NH3,10min后测得N2的浓度是0.8mol/L,则在这10min内NH3的平均反应速率是( )
| A. | 0.1 mol/(L•min) | B. | 0.2 mol/(L•min) | C. | 0.3 mol/(L•min) | D. | 0.6 mol/(L•min) |
3.茫茫黑夜中,航标灯为航海员指明了方向.航标灯的电源必须长效、稳定.我国科技工作者研制出以铝合金、PtFe合金网为电极材料的海水电池.在这种电池中下列说法正确的是( )
①铝合金是正极 ②铝合金是负极 ③海水是电解质溶液 ④铝合金电极发生还原反应.
①铝合金是正极 ②铝合金是负极 ③海水是电解质溶液 ④铝合金电极发生还原反应.
| A. | ②③ | B. | ②④ | C. | ①② | D. | ①④ |
20.若将乙醛通过下列两步反应转变成溴乙烷:CH3CHO$→_{催化剂,△}^{H_{2}}$CH3CH2OH$→_{△}^{+HBr}$CH3CH2Br,这两步反应分别属于有机反应类型中的( )
| A. | 加聚反应和水解反应 | B. | 消去反应和加成反应 | ||
| C. | 加成反应和取代反应 | D. | 加成反应和消去反应 |
17.下列关于化学键的说法正确的是( )
| A. | 构成单质分子的微粒一定含有共价键 | |
| B. | 非极性键只存在于双原子分子中 | |
| C. | 由非金属元素组成的化合物不一定是共价化合物 | |
| D. | 不同元素组成的多原子分子里的化学键一定是极性键 |
1.一个价电子构型为2s22p5的元素,下列有关其描述正确的有( )
| A. | 位于第2周期ⅦA族 | B. | 原子序数为7 | C. | 有最高正价+7 | D. | 电负性最大 |
16.砹是原子序数最大的卤族元素,根据卤素性质的递变规律,对砹及其化合物的叙述不正确的是( )
| A. | HAt非常稳定 | |
| B. | AgAt难溶于水 | |
| C. | 砹的非金属性在卤素中是最弱的,At-易被氧化 | |
| D. | 砹难溶于水,易溶于四氯化碳 |
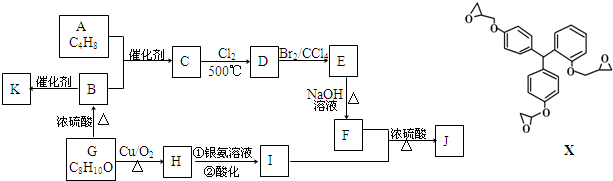
 .
.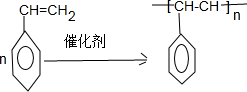 ;F+I→J
;F+I→J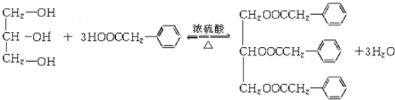 .
. (其中三种).
(其中三种).