题目内容
16.用铁片和稀硫酸反应时,下列措施不能使生成氢气的速率加快的是( )| A. | 对该反应体系加热 | B. | 不用稀硫酸,改用98%的浓硫酸 | ||
| C. | 加少量CuSO4溶液 | D. | 不用铁片,改用铁粉 |
分析 加快铁与稀硫酸的反应速率,可通过增大浓度、升高温度、形成原电池反应或者增大反应物接触面积等角度,浓硫酸能使Fe钝化.
解答 解:A.加热,升高温度可加快反应速率,故A不选;
B.浓硫酸能使Fe钝化,不能加快反应速率,故B选;
C.滴加少量CuSO4溶液,置换出Cu,形成原电池,发生电化学反应,反应速率加快,故C不选;
D.不用铁片,改用铁粉,增大反应物接触面积,反应速率加快,故D不选.
故选B.
点评 本题考查影响反应速率的因素,题目难度不大,本题注意温度、浓度、催化剂等条件对反应速率的影响,本题特别是注意原电池反应原理以及固体表面积对反应速率的影响.

练习册系列答案
相关题目
6.如表是元素周期表的一部分(注意:以下各空所涉及的元素填元素符号,不能用字母代替).
(1)写出元素符号:CAl、ECl;
(2)C的离子的结构示意图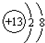 ;
;
(3)用电子式表示AD2的形成过程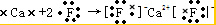 ;
;
(4)A-H八种元素中(填元素符号或化学式)
①原子半径最大的元素是K;单质的氧化性最强的元素是F;
②酸性最强的最高价氧化物对应水化物是HClO4;碱性最强的最高价氧化物对应水化物是KOH.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A |
(2)C的离子的结构示意图
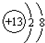 ;
;(3)用电子式表示AD2的形成过程
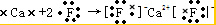 ;
;(4)A-H八种元素中(填元素符号或化学式)
①原子半径最大的元素是K;单质的氧化性最强的元素是F;
②酸性最强的最高价氧化物对应水化物是HClO4;碱性最强的最高价氧化物对应水化物是KOH.
11.一种元素最高价态的氧化物的水化物的化学式为H3XO4,则X的氢化物的化学式是( )
| A. | HX | B. | H2X | C. | XH3 | D. | XH4 |
1.一个价电子构型为2s22p5的元素,下列有关其描述正确的有( )
| A. | 位于第2周期ⅦA族 | B. | 原子序数为7 | C. | 有最高正价+7 | D. | 电负性最大 |
2.海水中含有丰富的镁资源.某同学设计了从模拟海水中制备MgO的实验方案:
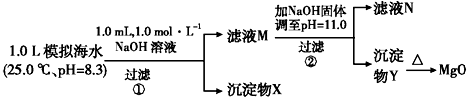
注:溶液中某种离子的浓度小于1.0×10-5 mol•L-1,可认为该离子不存在;
实验过程中,假设溶液体积不变.
KspCaCO3=4.96×10-9 KspMgCO3=6.82×10-6 KspCa(OH)2=4.68×10-6
KspMg(OH)2=5.61×10-12
下列说法不正确的是( )

| 模拟海水中的离 子浓度/mol•L-1 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
实验过程中,假设溶液体积不变.
KspCaCO3=4.96×10-9 KspMgCO3=6.82×10-6 KspCa(OH)2=4.68×10-6
KspMg(OH)2=5.61×10-12
下列说法不正确的是( )
| A. | 沉淀物X为CaCO3、MgCO3 | |
| B. | 滤液M中存在Mg2+,Ca2+ | |
| C. | 滤液N中存在Ca2+,没有Mg2+ | |
| D. | 步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为仍Mg(OH)2,没有Ca(OH)2 |
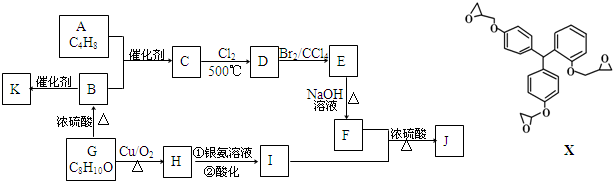
 .
. ;F+I→J
;F+I→J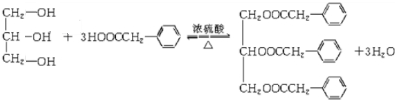 .
.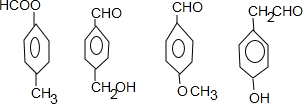 (其中三种).
(其中三种). (X)为卤素原子.
(X)为卤素原子.
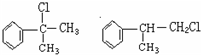 ;
; ;
;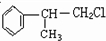 +NaOH$\stackrel{△}{→}$
+NaOH$\stackrel{△}{→}$ +NaCl;
+NaCl; 或
或 .
.
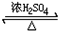 CH3COOC2H5+H2O
CH3COOC2H5+H2O