题目内容
6.已知部分弱酸的电离平衡常数如表:| 弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数(25℃) | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
| A. | 少量CO2通入NaClO溶液中:CO2+H2O+2ClO-═CO32-+2HClO | |
| B. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| C. | 少量SO2通入Na2CO3溶液中:SO2+H2O+2CO32-═SO32-+2HCO3- | |
| D. | 相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-═CO2↑+H2O |
分析 依据电离常数大小判断酸性强弱,H2SO3>HAc>H2CO3>HSO3->HClO>HCO3-,
A.次氯酸钠通入少量二氧化碳反应生成次氯酸和碳酸氢钠;
B.发生氧化还原反应生成硫酸钙;
C.二氧化硫少量反应生成亚硫酸钠和碳酸氢钠;
D.不能生成二氧化碳气体.
解答 解:依据电离常数大小判断酸性强弱,H2SO3>HAc>H2CO3>HSO3->HClO>HCO3-,
A.NaClO溶液中通入少量CO2,离子方程式为ClO-+H2O+CO2═HCO3-+HClO,故A错误;
B.向次氯酸钙溶液中通入少量SO2的离子反应为Ca2++ClO-+SO2+H2O═CaSO4↓+Cl-+2H+,故B错误;
C.Na2CO3溶液中缓慢通入少量SO2,离子方程式为2CO32-+H2O+SO2═SO32-+2HCO3-,故C正确;
D.由电离常数可知酸性HSO3-比碳酸弱,不能生成二氧化碳气体,故D错误.
故选C.
点评 本题考查了离子方程式的书写,侧重考查强酸制备弱酸的原理,依据图中电离常数判断酸性强弱是解题关键,题目难度不大.

练习册系列答案
相关题目
16.下列有关说法中,正确的是( )
| A. | 盐酸、漂白粉都是混合物 | B. | 127I和131I互为同素异形体 | ||
| C. | 硫酸铜、二氧化硫都是电解质 | D. | 分馏、干馏都是物理变化 |
17.下列物质既含有离子键又含有极性键和非极性键的是( )
| A. | KOH | B. | H2O2 | C. | CH3COONa | D. | NH4Cl |
1.pH=1酸溶液和pH=13碱溶液等体积混合后pH正确的是( )
| A. | 混合溶液的pH值应等于7 | |
| B. | 如果酸是强酸,则pH一定小于7 | |
| C. | 如果碱是强碱,则pH一定不大于7 | |
| D. | 如果混合液的pH大于7,则碱一定为强碱 |
11.利用原料气在合成塔中合成NH3,为加快正反应速率,且提高N2的转化率所采取的措施是( )
| A. | 加压 | B. | 移走氨气 | C. | 使用催化剂 | D. | 充入N2 |
18.一定条件下进行反应:A(g)?B(g)+C (g),向2.0L恒容密闭容器中充入1.0mol A(g),经过一段时间后达到平衡.反应过程中测得的有关数据如表:
下列说法正确的是( )
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(B)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A. | 反应前2min的平均速率v(B)=0.15 mol/(L•min) | |
| B. | 保持其他条件不变,升高温度,平衡时c(B)=0.22 mol•L-1,则反应的△H<0 | |
| C. | 保持其他条件不变,起始向容器中充入2.0 mol A,反应达到平衡时C的体积分数减小 | |
| D. | 保持其他条件不变,增大该反应体系的压强,平衡左移,反应的平衡常数K减小 |
15.如图为铜锌原电池示意图,下列说法中正确的是( )


| A. | 锌片逐渐溶解 | B. | 烧杯中溶液逐渐呈蓝色 | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 电解质溶液的pH保持不变 |
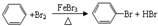 ,预测该芳香烃能(填“能”或“不能”)发生该类反应.
,预测该芳香烃能(填“能”或“不能”)发生该类反应.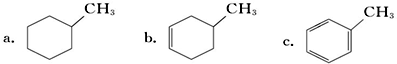
 c.
c.