题目内容
17.下列物质既含有离子键又含有极性键和非极性键的是( )| A. | KOH | B. | H2O2 | C. | CH3COONa | D. | NH4Cl |
分析 活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,据此分析解答.
解答 解:A.KOH中钾离子和氢氧根离子之间存在离子键、O-H原子之间存在极性键,故A错误;
B.双氧水分子中H-O原子之间只存在极性键、O-O原子之间只存在非极性键,故B错误;
C.醋酸钠中钠离子和醋酸根离子之间存在离子键、C-H原子之间存在极性键、C-C原子之间存在非极性键,故C正确;
D.氯化铵中铵根离子和氯离子之间存在离子键、铵根离子中N-H原子之间存在极性键,故D错误;
故选C.
点评 本题考查化学键判断,为高频考点,明确物质构成微粒及微粒之间作用力即可解答,注意醋酸钠中存在的化学键,为易错点.

练习册系列答案
相关题目
7.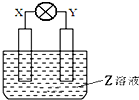 如图所示装置中,观察到电流计指针偏转,X棒变重,Y棒变轻,由此判断下表中所列X、Y、Z物质,其中可以成立的是( )
如图所示装置中,观察到电流计指针偏转,X棒变重,Y棒变轻,由此判断下表中所列X、Y、Z物质,其中可以成立的是( )
 如图所示装置中,观察到电流计指针偏转,X棒变重,Y棒变轻,由此判断下表中所列X、Y、Z物质,其中可以成立的是( )
如图所示装置中,观察到电流计指针偏转,X棒变重,Y棒变轻,由此判断下表中所列X、Y、Z物质,其中可以成立的是( )| X | Y | Z | |
| A | 锌 | 铜 | 稀硫酸溶液 |
| B | 铜 | 铁 | 稀盐酸 |
| C | 锌 | 铜 | 硝酸银溶液 |
| D | 碳 | 锌 | 硝酸铜溶液 |
| A. | 锌做负极溶解X电极变轻,错误 | |
| B. | 铁做负极失电子溶解变轻,X电极生成氢气不会变重,错误 | |
| C. | 锌做负极溶解X电极变轻,错误 | |
| D. | 锌做负极失电子发生氧化反应Y棒变轻,碳做正极溶液中铜离子析出使X极变重,正确 |
5.用铁酸钠(Na2FeO4)对自来水消毒是饮用水处理新技术,下列有关分析正确的是( )
| A. | 在Na2FeO4中Fe显+8价,具有强氧化性,所以能杀菌消毒 | |
| B. | 因为Na2FeO4溶液显碱性,所以能杀菌消毒 | |
| C. | Na2FeO4的还原产物为Fe3+,其易水解产生Fe(OH)3胶体,使水中悬浮物聚沉 | |
| D. | Na2FeO4的还原产物Fe2+ 水解,生成的胶体使水中悬浮物沉降,从而达到消毒目的 |
12.化学与社会、生活、环境等关系密切,下列有关说法正确的是( )
| A. | 铜属于重金属,但其盐有毒,所以铜质器皿不安全,应该禁用 | |
| B. | 食盐、食醋和味精是常用的食品添加剂,其主要化学成分均属钠盐 | |
| C. | 氨气液化以及液氨气化均要吸收大量的热,所以氨常用于制冷剂 | |
| D. | SO2能使食物增白,但这类食物会严重损害人体的肝肾,所以食品中应该严格限量使用 |
2.我们食用的鸡蛋中含有胆固醇(C27H46O).下列关于胆固醇的说法正确的是( )
| A. | 胆固醇属于有机化合物 | |
| B. | 胆固醇中碳、氢、氧三种元素的质量比为27:46:1 | |
| C. | 胆固醇是由27个碳原子、46个氢原子和1个氧原子构成的 | |
| D. | 胆固醇的相对分子质量是386g |
9.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.0 L 1.0 mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| C. | 常温常压下,92 g NO2和N2O4的混合气体中含有的原子总数为6NA | |
| D. | 标准状况下,22.4 L氨水含有NA个NH3分子 |
6.已知部分弱酸的电离平衡常数如表:
下列离子方程式正确的是( )
| 弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数(25℃) | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
| A. | 少量CO2通入NaClO溶液中:CO2+H2O+2ClO-═CO32-+2HClO | |
| B. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| C. | 少量SO2通入Na2CO3溶液中:SO2+H2O+2CO32-═SO32-+2HCO3- | |
| D. | 相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-═CO2↑+H2O |
7.下列所示的图象能反应相对应实验的是( )
| A. |  向pH=13的NaOH溶液中不断加水稀释 | |
| B. | 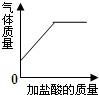 向碳酸氢钠溶液中逐滴加入稀盐酸至过量 | |
| C. | 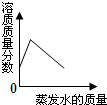 将60℃接近饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出 | |
| D. | 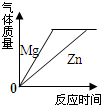 将足量的金属镁片和锌片分别和等质量、相同质量分数的稀硫酸混合 |
 的名称2,3-二甲基戊烷
的名称2,3-二甲基戊烷