题目内容
1.pH=1酸溶液和pH=13碱溶液等体积混合后pH正确的是( )| A. | 混合溶液的pH值应等于7 | |
| B. | 如果酸是强酸,则pH一定小于7 | |
| C. | 如果碱是强碱,则pH一定不大于7 | |
| D. | 如果混合液的pH大于7,则碱一定为强碱 |
分析 pH=1的酸和pH=13的碱的强弱均不明确,故应根据酸可能为强酸或弱酸、碱可能为强碱或弱碱来分别讨论,据此分析;
解答 解:A、由于pH=1的酸和pH=13的碱的强弱均不明确,故等体积混合后溶液的不一定显中性,故A错误;
B、若酸为强酸,当碱为强碱时,则pH=7;当碱为弱碱时,碱过量,则混合后溶液显碱性,即pH>7,故B错误;
C、如果碱为强碱,当酸为强酸时,则溶液的pH=7;当酸为弱酸时,酸过量,混合后溶液显酸性,即pH<7,即pH一定不大于7,故C正确;
D、当碱为强碱时,若酸为强酸,则溶液的pH等于7,当酸为弱酸时,溶液显酸性即pH小于7,即当碱为强碱时,混合后溶液不可能大于7,故D错误.
故选C.
点评 本题考查弱电解质的电离和盐类的水解知识,题目难度中等,本题注意酸碱性强弱的讨论.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.化学与社会、生活、环境等关系密切,下列有关说法正确的是( )
| A. | 铜属于重金属,但其盐有毒,所以铜质器皿不安全,应该禁用 | |
| B. | 食盐、食醋和味精是常用的食品添加剂,其主要化学成分均属钠盐 | |
| C. | 氨气液化以及液氨气化均要吸收大量的热,所以氨常用于制冷剂 | |
| D. | SO2能使食物增白,但这类食物会严重损害人体的肝肾,所以食品中应该严格限量使用 |
9.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.0 L 1.0 mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| C. | 常温常压下,92 g NO2和N2O4的混合气体中含有的原子总数为6NA | |
| D. | 标准状况下,22.4 L氨水含有NA个NH3分子 |
16.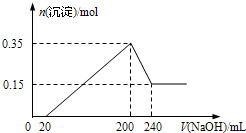 将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
 将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )| A. | Mg和Al的总质量为8 g | |
| B. | 硫酸的物质的量浓度为5 mol/L | |
| C. | NaOH溶液的物质的量浓度为5 mol/L | |
| D. | 生成的H2在标准状况下的体积为11.2 L |
6.已知部分弱酸的电离平衡常数如表:
下列离子方程式正确的是( )
| 弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数(25℃) | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
| A. | 少量CO2通入NaClO溶液中:CO2+H2O+2ClO-═CO32-+2HClO | |
| B. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| C. | 少量SO2通入Na2CO3溶液中:SO2+H2O+2CO32-═SO32-+2HCO3- | |
| D. | 相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-═CO2↑+H2O |
13.将乙醛和乙酸分离的正确方法是( )
| A. | 加热蒸馏 | |
| B. | 利用银镜反应进行分离 | |
| C. | 加入Na2CO3后,通过萃取的方法分离 | |
| D. | 先加入烧碱溶液,之后蒸馏出乙醛;再加入浓硫酸,蒸馏出乙酸 |
 铜及其化合物在工业、农业、科技和日常生活中有广泛应用.
铜及其化合物在工业、农业、科技和日常生活中有广泛应用.