题目内容
【题目】室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )
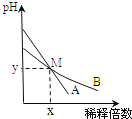
A.稀释前,![]()
B.稀释前,A溶液中由水电离出的![]() 的浓度大于
的浓度大于![]()
C.用醋酸中和A溶液至恰好完全反应时,溶液的pH为7
D.在M点,A、B两种碱溶液中阳离子的物质的量浓度相等
【答案】D
【解析】
A、由稀释时B的pH下降较慢知,B是比A弱的碱,B溶液的pH比A小1,则![]() ,故A错误;
,故A错误;
B、稀释前A溶液中氢氧根离子浓度大于B溶液中;碱是抑制水的电离;稀释前,A溶液中由水电离出的![]() 的浓度小于
的浓度小于![]()
![]() ,故B错误;
,故B错误;
C、用醋酸中和A溶液至恰好完全反应时,醋酸是弱酸,生成的醋酸根离子水解显碱性,故C错误;
D、M点AB溶液pH相同,氢氧根离子浓度相同,所以M点A、B两种碱溶液中阳离子的物质的量浓度相等,故D正确;
故选D。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】纪录片《我在故宫修文物》展示了专家精湛的技艺和对传统文化的热爱与坚守,也让人体会到化学方法在文物保护中的巨大作用。
Ⅰ.某博物馆修复出土铁器的过程如下:
(1)检测锈蚀物的成分。
锈蚀物主要成分的化学式 | |||
Fe3O4 | Fe2O3·H2O | FeO(OH) | FeOCl |
FeOCl中铁元素的化合价为_______。
(2)化学修复方法:脱氯、还原,形成Fe3O4保护层。(已知:Cl-会加快铁的腐蚀)
修复过程:将铁器浸没在盛有0.5 mol·L-1 Na2SO3、0.5 mol·L-1 NaOH溶液的容器中,缓慢加热至60~90℃,一段时间后取出器物,用NaOH溶液洗涤至无Cl-。
①脱氯反应:FeOCl + OH- = FeO(OH) + Cl-。离子反应是向着离子浓度减小的方向进行的,则相同温度下,FeOCl与FeO(OH)的溶解度:s(FeOCl)______s[FeO(OH)](填>、<或=)。
②还原反应:Na2SO3还原FeO(OH)形成Fe3O4。配平化学方程式:
___Na2SO3 + ___FeO(OH) = ___Na2SO4 + ___Fe3O4 + ___H2O
③检验Cl-是否洗涤干净的方法是_______________。
Ⅱ.若要配制500mL 0.5mol·L-1的NaOH溶液用于洗涤器物,回答下列问题:
(3)配制时,应用天平称取NaOH的质量为___________(精确到小数点后两位)。
(4)某操作步骤如图所示:
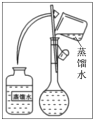
该操作应放在如图所示的____________(填序号)操作之间。
①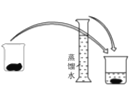 ②
②![]() ③
③![]() ④
④![]() ⑤
⑤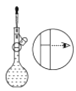 ⑥
⑥![]()
(5)下列说法错误的是_____________(填标号)。
A.称量NaOH固体的时间不宜过长
B.待烧杯中溶液冷却至室温才进行转移
C.定容时,仰视容量瓶刻度线会使配制的NaOH溶液浓度偏高
D.容量瓶可存放配好的NaOH溶液