题目内容
【题目】燃料电池是利用燃料(如H2、CO、CH4、CH3OH、NH3等)与O2反应从而将化学能转化为电能的装置。
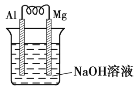
(1)燃料电池(NaOH作电解质溶液)的正极电极反应式为__。
瑞典ASES公司设计的曾用于驱动潜艇的液氨液氧燃料电池示意图如图所示,有关说法不正确的是(________)

A.电池工作时,Na+向正极移动
B.电子由电2经外电路流向电极1
C.电极总应为4NH3+3O2=2N2+6H2O
D.电极2发生的电极反应为O2+4H++4e-=2H2O
(2)葡萄糖为燃料的微生物燃料电池结构示意图如图所示。

葡萄糖作为微生物燃料电池的___(填“正”或“负”)极。
微生物燃料电池___(填“能”或“不能”在高温下工作。
(3)CO无色无味有毒,世界各国每年均有不少人因CO中毒而失去生命。一种CO分析仪的工作原理所示,该装置中电解质为氧化钇一氧化钠,其中O2可以在固体介质NASICON中自由移动。传感器中通过电极反应测定尾气中CO的含量越高,请回答:

电极反应式为___。
(4)PbO溶解在HCl和NaCl的混合溶液中,得到含电解质Na2PbCl4溶液,电解Na2PbCl4溶液生成Pb的装置如图所示。

电解时阴的电极反应式___。
其过程中通过阳离子交换膜的离子主要为___。
过程中,Na2 PbCl4电解液浓度不断减小,为了恢复其浓度向阴极室加___(填化学式)。
【答案】O2+2H2O+4e-=4OH- BD 负极 不能 CO2e+O2═CO2 PbCl42+2e-═Pb+4Cl H+ 继续向阴极区加PbO
【解析】
(1)燃料电池中燃料氢气在负极失电子发生氧化反应,氧气在正极上得到电子发生还原反应;液氨液氧燃料电池中,根据图示可知电极1上氨气转换为氮气,化合价升高,发生氧化反应,故电极1为负极,电极2为正极,燃料电池中,阳离子向正极移动,电子从负极移动到正极,在燃料电池的负极上发生燃料失电子的氧化反应,在正极上氧气发生得电子的还原反应;碱性条件下,电极2发生的电极反应为O2+2H2O+4e-=4OH-,碱性溶液中不应该出现H+;
(2)葡萄糖为燃料的微生物燃料电池,通氧气为生物燃料电池的正极;负极是葡萄糖失电子生成二氧化碳,在高温下,微生物会死亡,不能做微生物燃料电池;
(3)如图所示,反应本质是CO与氧气反应生成CO2,CO在a极发生氧化反应,故a为负极;b为正极,阴离子向负极移动,O2由电极b流向电极a,负极电极反应式为:CO2e+O2═CO2;
(4)根据电化学原理可知,阴极发生还原反应,则Na2PbCl2得到电子生成Pb,电极反应式为:PbCl42+2e-═Pb+4Cl,阳极发生氧化反应,溶液中的H2O放电生成氧气和氢离子,电极反应式为:2H2O4e═O2+4H+,质子交换膜可以允许氢离子向阳极移动,电解一段时间后,Na2PbCl2的浓度极大减小,为了恢复其浓度且实现物质的循环利用,根据少什么加什么的原则,溶液中减少了Pb和O,应该在阴极区加PbO,
(1)氧气在正极上得到电子发生还原反应;燃料电池(NaOH作电解质溶液)的正极电极反应式为O2+2H2O+4e-=4OH-,液氨液氧燃料电池中,根据图示可知电极1上氨气转换为氮气,化合价升高,发生氧化反应,故电极1为负极,电极2为正极,
A. 燃料电池中的阳离子向正极移动,电池工作时Na+向正极移动,故A正确;
B. 燃料电池中,电子是从负极流向正极,电子由电极1极经外电路流向电极2,故B错误;
C. 燃料电池的总反应是燃料燃烧的化学方程式电极总应为4NH3+3O2=2N2+6H2O,故C正确;
D. 在燃料电池的负极上发生燃料失电子的氧化反应,在正极上氧气发生得电子的还原反应;碱性条件下,电极2发生的电极反应为O2+2H2O+4e-=4OH-,碱性溶液中不应该出现H+,故D错误;
故答案为:O2+2H2O+4e-=4OH-;BD;
(2)葡萄糖为燃料的微生物燃料电池,通氧气为生物燃料电池的正极;负极是葡萄糖失电子生成二氧化碳,在高温下,微生物会死亡,不能做微生物燃料电池,
故答案为:负极;不能;
(3)本质是CO与氧气反应生成CO2,CO在a极发生氧化反应,故a为负极;b为正极,阴离子向负极移动,O2由电极b流向电极a,负极电极反应式为:CO2e+O2═CO2,
故答案为:CO2e+O2═CO2;
(4)根据电化学原理可知,阴极发生还原反应,则Na2PbCl2得到电子生成Pb,电极反应式为:PbCl42+2e-═Pb+4Cl,阳极发生氧化反应,溶液中的H2O放电生成氧气和氢离子,电极反应式为:2H2O4e═O2+4H+,质子交换膜可以允许氢离子向阳极移动,电解一段时间后,Na2PbCl2的浓度极大减小,为了恢复其浓度且实现物质的循环利用,根据少什么加什么的原则,溶液中减少了Pb和O,应该在阴极区加PbO,
故答案为:PbCl42+2e-═Pb+4Cl;H+;继续向阴极区加PbO。