题目内容
【题目】如图所示,将锌、铜通过导线相连,置于稀硫酸中:
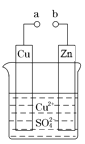
(1)锌片上的现象是______,电极反应为________。
(2)铜片上的现象是_________,电极反应为_________。
(3)电子由________经导线流向_____________。
(4)若反应过程中有0.2 mol电子发生转移,则生成的氢气在标准状况下的体积为 ______。
【答案】锌片逐渐溶解 Zn-2e-=Zn2+ 铜片上有气泡产生 2H++2e-=H2↑ 锌片 铜片 2.24 L
【解析】
将锌、铜通过导线相连,置于稀硫酸中,形成了Cu-Zn原电池,Zn作负极,Cu作正极。
(1)Zn作负极,失电子,化合价升高,被氧化,电极反应式为:Zn-2e-=Zn2+,现象为锌片逐渐溶解,故答案为:锌片逐渐溶解;Zn-2e-=Zn2+;
(2)Cu作正极,H+在正极得电子,化合价降低,被还原,电极反应式为:2H++2e-=H2↑,现象为:铜片上有气泡产生,故答案为:铜片上有气泡产生;2H++2e-=H2↑;
(3)电子由负极经导线流向正极,所以,电子由锌片经导线流向铜片,故答案为:锌片;铜片;
(4)由2H++2e-=H2↑可知,每转移2mol电子,生成1mol氢气,所以,转移0.2mol电子,生成0.1mol氢气,即2.24L,故答案为:2.24 L。

【题目】下列实验过程中对应的变化与右图相符合的是
实验过程 | X | Y |
| |
A | 稀HCl滴加到NaOH溶液中 | V(HCl) | N(Na+) | |
B | 铁粉加入 CuSO4溶液中 | m(Fe) | m(固 体) | |
C | CO2通入NaOH溶液中 | V(CO2) | 溶液的导电能力 | |
D | 稀H2SO4滴加到 Ba(OH)2溶液中 | V(H2SO4) | 溶液的导电能力 |
A. A B. B C. C D. D
【题目】用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:
H2O2+I-=H2O+IO-;H2O2+IO-=H2O+O2↑+I-。总反应的化学方程式是________________。
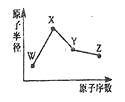
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是___________(填字母)。
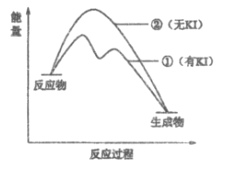
a. 加入KI后改变了反应的路径
b. 加入KI后改变了总反应的能量变化
c. H2O2+I-=H2O+IO-是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
①加CCl4并振荡、静置后还可观察到___________,说明有I2生成。
②气泡明显减少的原因可能是:i. H2O2浓度降低;ii. ________。以下对照实验说明i不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是_____________。
(4)资料4:I-(aq)+I2(aq)![]() I3-(aq) K=640。
I3-(aq) K=640。
为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10mL 0.10mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
微粒 | I- | I2 | I3- |
浓度/(mol·L-1) | 2.5×10-3 | a | 4.0×10-3 |
①a=__________。
②该平衡体系中除了含有I-,I2,I3-外,一定还含有其他含碘微粒,理由是________________。