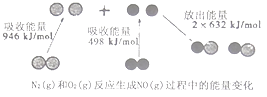
题目内容
【题目】SO2是大气污染物之一,为探究SO2气体的性质,某实验小组利用如图1所示装置进行实验。
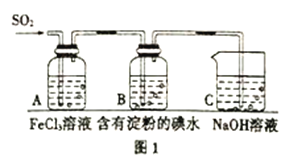
(1)装置A中发生反应的离子方程式为:______________;
(2)装置C的作用是:______________;
(3)在上述装置中通入过量的SO2,为了验证A 中SO2 与Fe3+发生了氧化还原反应,取A 中的溶液少 量,分成两份,并设计了如下实验方案:
方案①:向第一份溶液中加入少量酸性KMnO4溶液,发现紫红色褪去;
方案②,向第二份溶液中加入少量KSCN 溶液,发现不变红,再加入少量新制的氯水,深液变红;
上述方案中不合理的是:________,原因是: ________________;
(4)能表明I-的还原性弱于SO2 的现象是: ________________;
(5)设计实验验证反应结束后A 装置中的Cl-:________________;
(6) 该小组同学设计实验模报测定硫酸工业生产排放的尾气中SO2的体积分数(其他气体均难溶于水且不发生任何反应),选用了如图2所示的简易实验装置。
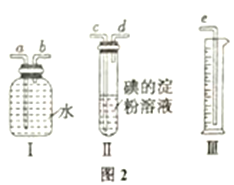
①若混合气体的流向按从左向右时,右图装置组装连接的顺序合理的是:混合气体→A (填写a、b等仪器接口字母)。___________
②你认为下列试剂中,可以用来代替试管中碘的淀粉溶液的是:______ (填标号);
A.酸性KMnO4溶液 B.NaOH 溶液 C.溴水 D.氨水
③若碘溶液的浓度为0.05 mol/L、体积为30 mL,与SO2气体恰好完全反应时,量简内水的体积为386.4 mL(已折算为标准状况下的体积)。则SO2的体积分数为:_______。
【答案】 SO2+2H2O +2Fe3+=2Fe2++SO42-+4H+ 吸收未反应的二氧化硫,防污梁空气 方案① 过量的二氧化硫能溶于水,也能使酸性高锰酸钾溶液褪色 B中蓝色褪去 取反应结束后A装置中适量溶液于试管中,先加入足量的Ba(NO3)2溶液,沉淀完全后取上层清液加适量的AgNO3溶液,观察是否有白色沉淀 c→d→b→a→e A、C 8%
【解析】(1)装置A中二氧化硫与铁离子发生氧化还原反应生成硫酸根和亚铁离子,反应的离子方程式为:SO2+2H2O+2Fe3+===2Fe2++SO42-+4H+。(2)二氧化硫有毒,会污染空气,所以要有尾气吸收装置,因此装置C的作用是吸收未反应的二氧化硫,防止污染空气。(3)由于过量的二氧化硫能溶于水,也能使酸性高锰酸钾溶液褪色,所以方案①不合理。(4)碘能与二氧化硫反应生成碘离子和硫酸根离子,则装置B中蓝色褪色,据此可判断I-的还原性弱于SO2。(5)要检验氯离子,需要排除硫酸根以及亚硫酸根离子的干扰,因此实验方案是:取反应结束后A装置中适量溶液于试管中,先加入足量的Ba(NO3)2溶液,沉淀完全后取上层清液加适量的AgNO3溶液,观察是否有白色沉淀;(6)①原料气通过碘的淀粉溶液,碘能氧化H2SO3,生成H2SO4,吸收二氧化硫气体,通过装置Ⅰ、Ⅲ排水量测定氮气的体积,因此连接装置接口顺序为:混合气体→A→c→d→b→a→e;②二氧化硫具有还原性,可以利用酸性高锰酸钾溶液吸收,且现象明显,氢氧化钠溶液虽能吸收二氧化硫但无明显现象,溴水可以吸收二氧化硫使其褪色,现象明显,氨水可以吸收二氧化硫,但无明显现象,答案选AC;③反应的方程式为I2+SO2+2H2O===2I-+SO42-+4H+,由条件知n(SO2)=n(I2)=0.05 mol/L×0.03 L=0.0015 mol,即33.6 mL,所以工业原料气总体积为 386.4 mL+33.6 mL=420.0 mL,因此其中SO2的体积分数为33.6/420×100%=8%。

【题目】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还含有一定量的SiO2)可用于制备FeCO3,其流程如下:
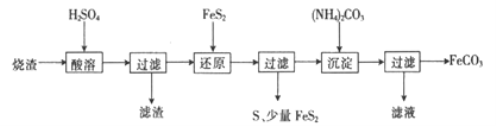
已知:还原时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应ⅠW为
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+。
(1)反应Ⅰ中还原剂是_________
(2)滤渣的成分是_______(填名称)。
(3)所得FeCO3需充分洗涤,检验FeCO3是否洗净的方法是____________
(4)①配平反应的离子方程式: ![]() ____________
____________
②还原前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
离子 | 离子浓度(mol/L) | |
还原前 | 还原后 | |
Fe2+ | 0.10 | 2.50 |
SO42- | 3.50 | 3.70 |
则反应Ⅰ、Ⅱ中生成Fe2+的物质的量之比为______________