题目内容
【题目】根据杂化轨道理论和价电子对互斥理论模型判断,下列分子或离子的中心原子杂化方式及空间构型正确的是( )
选项 | 分子或离子 | 中心原子杂化方式 | 价电子对互斥理论模型 | 分子或离子的空间构型 |
A | H2O | sp1 | 直线形 | 直线形 |
B | BBr3 | sp2 | 平面三角形 | 三角锥形 |
C | PCl3 | sp2 | 四面体形 | 平面三角形 |
D | CO32- | sp2 | 平面三角形 | 平面三角形 |
A.AB.BC.CD.D
【答案】D
【解析】
A.H2O中心原子O原子的价层电子对数=2+![]() =4,杂化方式为sp3,价层电子对互斥模型为四面体形,分子的立体构型为V型结构,故A错误;
=4,杂化方式为sp3,价层电子对互斥模型为四面体形,分子的立体构型为V型结构,故A错误;
B.BBr3分子中心原子B原子的价层电子对数=3+![]() =3,杂化方式为sp2,价层电子对互斥模型为平面三角形,分子的立体构型为平面三角形,故B错误;
=3,杂化方式为sp2,价层电子对互斥模型为平面三角形,分子的立体构型为平面三角形,故B错误;
C.PCl3分子中心原子P原子的价层电子对数=3+![]() =4,杂化方式为sp3,价层电子对互斥模型为四面体形,分子的立体构型为三角锥形,故C错误;
=4,杂化方式为sp3,价层电子对互斥模型为四面体形,分子的立体构型为三角锥形,故C错误;
D.CO32-分子中心原子C原子的价层电子对数=3+![]() =3,杂化方式为sp2,价层电子对互斥模型为平面三角形,分子的立体构型为平面三角形,故D正确;
=3,杂化方式为sp2,价层电子对互斥模型为平面三角形,分子的立体构型为平面三角形,故D正确;
故选D。

练习册系列答案
相关题目
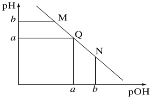
【题目】在20 L的密闭容器中按物质的量之比1∶2充入CO和H2,发生反应CO(g)+2H2(g)CH3OH(g) ΔH。测得CO的转化率随温度的变化及不同压强下CO的变化如图所示,p2和195 ℃时n(H2)随时间的变化结果如下表所示。下列说法正确的是( )
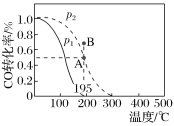
p2和195 ℃时n(H2)
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 5 | 4 | 4 |
A.p2和195 ℃时,0~3 min,反应速率v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
B.p1<p2,ΔH>0
C.195 ℃、p2时,在B点:v正>v逆
D.在p2和195 ℃时,该反应的平衡常数为25