题目内容
【题目】有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。已知A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍;![]() 在同周期元素中原子半径最小。
在同周期元素中原子半径最小。
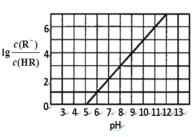
(1)B形成的双原子分子中,共价键的类型有__,化合物A2B中B原子采取__杂化。
(2)A2B和A2D的沸点较高者是__(填化学式),其原因是_。
(3)E原子的电子排布式为__。
(4)写出均由A、B、C、D四种元素组成的两物质的浓溶液发生反应的离子方程式:__。
【答案】σ键、π键 sp3 H2O 水分子间能形成氢键,使其沸点高于H2S 1s22s22p63s23p5(或[Ne]3s23p5) H++HSO3-=H2O+SO2↑
【解析】
有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍,则A是H元素,C是Na元素,因此B是O元素,D是S元素,E在同周期元素中原子半径最小,且为主族的短周期元素,所以E是Cl元素,据此分析解答。
依据上述分析可知:A为氢,B为氧,C为钠,D为硫,E为氯。
(1)O形成的双原子分子是氧气,氧气分子的结构式为O=O,从轨道重叠的角度来看共价键的类型有头对头的σ键和肩并肩的π键;化合物A2B为H2O,H2O中O原子的价层电子对个数=2+![]() =4,含有2个孤电子对,所以H2O的VSEPR模型为四面体,分子空间构型为V型,中心原子杂化方式为sp3,故答案为:σ键和π键;sp3;
=4,含有2个孤电子对,所以H2O的VSEPR模型为四面体,分子空间构型为V型,中心原子杂化方式为sp3,故答案为:σ键和π键;sp3;
(2)H2O分子间存在氢键而H2S分子间不存在氢键,故H2O的沸点比H2S高,故答案为:H2O;水分子间能形成氢键,使其沸点高于H2S;
(3)E是Cl元素,其原子核外有17个电子,根据构造原理知,Cl原子的电子排布式为1s22s22p63s23p5,故答案为:1s22s22p63s23p5 ;
(4)由H、O、Na、S四种元素组成的两物质分别为:硫酸氢钠和亚硫酸氢钠,它们的浓溶液发生反应的离子方程式:H++HSO3-=H2O+SO2↑,故答案为:H++HSO3-=H2O+SO2↑。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】根据杂化轨道理论和价电子对互斥理论模型判断,下列分子或离子的中心原子杂化方式及空间构型正确的是( )
选项 | 分子或离子 | 中心原子杂化方式 | 价电子对互斥理论模型 | 分子或离子的空间构型 |
A | H2O | sp1 | 直线形 | 直线形 |
B | BBr3 | sp2 | 平面三角形 | 三角锥形 |
C | PCl3 | sp2 | 四面体形 | 平面三角形 |
D | CO32- | sp2 | 平面三角形 | 平面三角形 |
A.AB.BC.CD.D