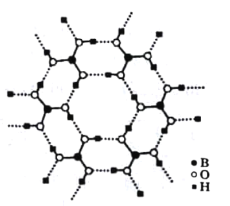
题目内容
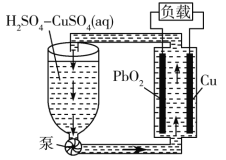
【题目】氧化铅-铜电池是一种电解质可循环流动的新型电池(如图所示),电池总反应为![]()
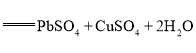 。下列有关该电池的说法正确的是( )
。下列有关该电池的说法正确的是( )
A.电池工作时,电子由Cu电极经电解质溶液流向PbO2电极
B.电池工作过程中,电解质溶液的质量逐渐减小
C.正极反应式:
D.电池工作过程中,两个电极的质量均减小
【答案】C
【解析】
根据电池总反应![]()
 可知,电池工作时,PbO2得电子作正极,电极反应式为
可知,电池工作时,PbO2得电子作正极,电极反应式为![]()
 ,Cu失去电子作负极,电极反应式为Cu-2e-=Cu2+,据此分析解答。
,Cu失去电子作负极,电极反应式为Cu-2e-=Cu2+,据此分析解答。
A.电池工作时,电子不能流经电解质溶液,只能在外电路中流动,A选项错误;
B.由电池总反应可知,若反应的PbO2为1mol,则电解质溶液中增加了2mol O、1mol Cu,减少了1mol![]() ,则增加和减少的质量相等,反应前后电解质溶液的质量不变,B选项错误;
,则增加和减少的质量相等,反应前后电解质溶液的质量不变,B选项错误;
C.由电池总反应可知,PbO2得电子,正极反应式为![]()
 ,C选项正确;
,C选项正确;
D.正极反应生成的PbSO4附着在PbO2电极上,其质量增加,D选项错误;
答案选C。

【题目】一定温度下,在三个体积为1.0 L的恒容密闭容器中发生反应:2CH3OH(g)CH3OCH3(g)+H2O(g)
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法不正确的是
A.该反应为放热反应
B.容器I达到平衡所需要的时间比容器Ⅲ短
C.达到平衡时,容器I中的CH3OH体积分数大于容器Ⅱ
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
【题目】实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:
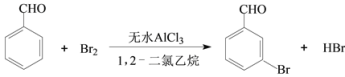
已知:(1)间溴苯甲醛温度过高时易被氧化。
(2)溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点见下表:
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如右图所示),缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。

步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出
MgSO4nH2O晶体。
步骤4:减压蒸馏有机层,收集相应馏分。
(1)实验装置中冷凝管的主要作用是_____,锥形瓶中应为_____(填化学式)溶液。
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为(填序号)_______。
A.>229℃ B.58.8℃~179℃ C.<58.8℃
(3)步骤2中用10% NaHCO3溶液洗涤,是为了除去溶于有机层的___(填化学式)。
(4)步骤3中加入无水MgSO4固体的作用是_____。
(5)步骤4中采用减压蒸馏,是为了防止______。
(6)若实验中加入了5.3 g苯甲醛,得到3.7 g间溴苯甲醛。则间溴苯甲醛产率为______。