题目内容
【题目】某同学做如下实验: 上面对照实验不能完成实验目的的是

A.![]() 、
、![]() 对照,比较
对照,比较![]() 、
、![]() 中羟基氢原子的活泼性
中羟基氢原子的活泼性
B.![]() 、
、![]() 对照,说明
对照,说明![]() 中存在不同于烃分子中的氢原子
中存在不同于烃分子中的氢原子
C.![]() 、
、![]() 对照,能说明苯环对羟基的化学性质产生影响
对照,能说明苯环对羟基的化学性质产生影响
D.![]() 和
和![]() 、
、![]() 和
和![]() 对照,说明官能团对有机物的化学性质起决定作用
对照,说明官能团对有机物的化学性质起决定作用
【答案】C
【解析】
A. 与钠反应越剧烈,说明分子中羟基氢越活泼;
B. 乙醇与钠反应生成气体,而煤油不反应,说明乙醇分子中含有不同于烃分子中的氢原子;
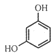
C. 苯酚与溴水反应,证明了羟基对苯环产生影响;
D. ![]() 和
和![]() 、
、![]() 和
和![]() 对照,说明醇羟基、酚羟基等官能团决定了有机物的性质。
对照,说明醇羟基、酚羟基等官能团决定了有机物的性质。
A. 钠与水反应剧烈程度远大于钠在乙醇中反应的剧烈程度,所以①、②对照可以比较水和乙醇中羟基氢原子的活泼性,A项正确,不符合题意;
B. 乙醇和煤油中都含有烃分子,但钠在乙醇中反应现象和钠在煤油中的反应现象不同,说明乙醇中存在不同于烃分子中的氢原子,B项正确,不符合题意;
C. 溴水与苯不反应,而苯酚中有苯环外,还有酚羟基,由于酚羟基对苯环影响,使苯环上的邻对的H原子非常活泼,所以苯酚能与溴水反应生成三溴苯酚,说明羟基对苯环的化学性质产生了影响,C项错误,符合题意;
D.经过上面五组对照实验可得知官能团对有机物的化学性质起决定性作用,D项正确,不符合题意;
答案选C。

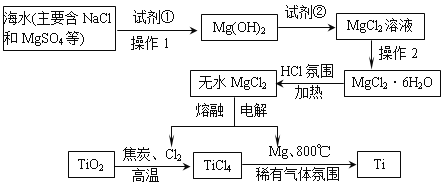
【题目】目前世界上60%的镁是从海水中提取的,从海水中提取的MgCl2制得Mg和Cl2,进一步联合用金红石(主要成分TiO2)冶炼金属钛,工业上其主要的生产流程如下:
|
回答下列问题:
(1)加入过量试剂①后,能够分离得到Mg(OH)2沉淀的方法操作1用到的玻璃仪器有________________________________________;试剂②可以选用______。
(2)要得到MgCl2·6H2O的操作2名称是___________________________________。
(3)工业上冶炼金属钛的上述生产流程,其第1步是在高温下向金红石(主要成分TiO2)与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃性气体,写出这步反应的化学方程式:____________________________。
(4) 工业上冶炼金属钛的上述生产流程,其第2步是在稀有气体氛围和加热的条件下,用镁与TiCl4反应得到钛,写出这步反应的化学方程式____________________,该反应时稀有气体氛围的作用是_____________________________________,该反应的金属冶炼方法属于是____________________。
【题目】在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:
A | |||||||||
C | D | ||||||||
B | E | F | |||||||
(1)画出D的原子结构示意图________ ;
(2)A和F两种元素组成的化合物中含有的化学键是_____(填“共价”或“离子”)键。;
(3)E和F分别形成的气态氢化物中最稳定的是_________(填写氢化物的化学式)
(4)B的最高价氧化物的水化物的化学式_____________。