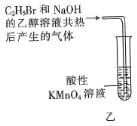
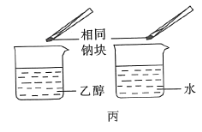
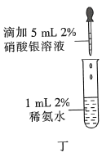
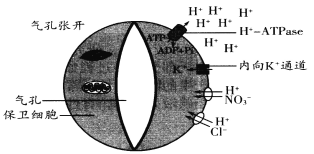
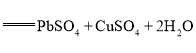题目内容
【题目】一定温度下,在三个体积为1.0 L的恒容密闭容器中发生反应:2CH3OH(g)CH3OCH3(g)+H2O(g)
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法不正确的是
A.该反应为放热反应
B.容器I达到平衡所需要的时间比容器Ⅲ短
C.达到平衡时,容器I中的CH3OH体积分数大于容器Ⅱ
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
【答案】C
【解析】
A.根据表格数据I和Ⅲ,容器Ⅰ、Ⅲ起始量相同,降低温度,平衡向放热的方向移动,CH3OCH3(g) 平衡物质的量增大,说明平衡正向移动,说明正反应为放热反应,故A正确;
B.容器Ⅰ中的温度比容器Ⅲ的温度高,温度越高,反应速率越快,达到平衡所需时间越短,即容器I达到平衡所需要的时间比容器Ⅲ短,故B正确;
C.恒容条件下,容器Ⅱ相当于在容器Ⅰ的基础上加压,由于该反应是反应前后气体物质的量不变的反应,因此平衡不移动,所以容器Ⅰ中的CH3OH体积分数和容器Ⅱ中的相等,故C错误;
D.容器I平衡时c(CH3OH)=0.04mol/L、c(CH3OCH3 )=0.08mol/L、c(H2O)=0.08mol/L,平衡常数K=![]() =4,若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则c(CH3OH)=0.1mol/L、c(CH3OCH3 )=0.15mol/L、c(H2O)=0.10mol/L,浓度商=
=4,若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则c(CH3OH)=0.1mol/L、c(CH3OCH3 )=0.15mol/L、c(H2O)=0.10mol/L,浓度商=![]() =1.5<4,平衡向正反应方向移动,故D正确;
=1.5<4,平衡向正反应方向移动,故D正确;
故选C。

 阅读快车系列答案
阅读快车系列答案【题目】近几年来关于氮污染的治理备受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图所示。
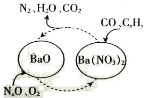
若NO、NO2的体积比为1∶1,写出氧化钡生成Ba(NO3)2的化学方程式:_______________________。从最终排放的气体来看,氮元素将_______________________(填“被氧化”或“被还原”)。
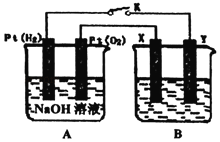
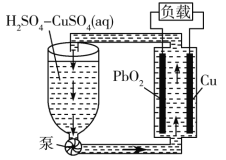
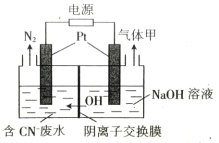
(2)用电解法将某工业废水中CN-转变为N2,装置如下图所示。电解过程中,阴极区电解质溶液的pH将_______________________(填“增大”、“减小”或“不变”)。阳极的电极反应式为_______________________。
(3)汽车尾气中催化剂可将NO、CO转化成无害气体。2NO+2CO![]() N2+2CO2 ΔH
N2+2CO2 ΔH
化学键 | C≡O | NO中氮氧键 | N≡N | CO2中C=O键 |
键能(kJ/mol) | 1076 | 630 | 945 | 803 |
①ΔH=_________________kJ/mol
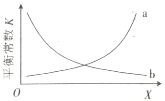
②该反应的平衡常数与外界因素X[代表温度、压强、![]() 或催化剂接触面积]的关系如图所示。X是________________,能正确表达平衡常数K随X变化的曲线是________________(填“a”或“b”)。
或催化剂接触面积]的关系如图所示。X是________________,能正确表达平衡常数K随X变化的曲线是________________(填“a”或“b”)。
(4)在一定温度和催化剂作用下:8NH3(g)+8NO(g)+2NO2(g)![]() 9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟达到平衡时,c(NH3)=0.5mol/L、c(NO2)=0.25mol/L。
9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟达到平衡时,c(NH3)=0.5mol/L、c(NO2)=0.25mol/L。
①n=_____________________________;
②v(NO)=_______________;
③NH3的平衡转化率为_______________。