题目内容
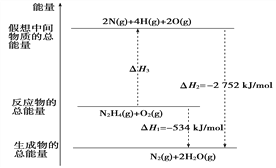
【题目】一种新型锰氢二次电池原理如图所示。该电池以MnSO4溶液为电解液,碳纤维与Pt/C分别为电极材料,电池的总反应为Mn2++ 2H2O![]() MnO2 + 2H++ H2↑。下列说法错误的是
MnO2 + 2H++ H2↑。下列说法错误的是

A. 充电时,碳纤维电极做阳极
B. 充电时,碳纤维电极附近溶液的pH增大
C. 放电时,电子由Pt/C电极经导线流向碳纤维电极
D. 放电时,正极反应式为MnO2 + 4H++ 2e-=Mn2++ 2H2O
【答案】B
【解析】
新型电池放电时是原电池,碳纤维表面MnO2发生还原反应生成Mn2+,为正极;充电时是电解池,碳纤维表面Mn2+发生氧化反应生成MnO2,为阳极。
A.充电时是电解池,碳纤维表面Mn2+发生氧化反应生成MnO2,则碳纤维电极做阳极,故A正确;
B.充电时,碳纤维电极发生的电极反应为Mn2++ 2H2O-2e-= MnO2 + 4H+,附近溶液的pH减小,故B错误;
C.放电时是原电池,碳纤维为正极,Pt/C为负极,则电子由Pt/C电极经导线流向碳纤维电极,故C正确;
D.放电时,碳纤维表面MnO2发生还原反应生成Mn2+,电极反应式为MnO2 + 4H++ 2e-=Mn2++ 2H2O,故D正确;答案为B。

【题目】电子工业上使用![]() 溶液蚀刻铜箔制造印刷电路板。在该制备工艺中,为了实现资源再生,减少污染,某兴趣小组提出废液处理和资源回收的过程如下:
溶液蚀刻铜箔制造印刷电路板。在该制备工艺中,为了实现资源再生,减少污染,某兴趣小组提出废液处理和资源回收的过程如下:
Ⅰ.向废液中投入过量铁屑,充分反应后分离出固体和滤液;
Ⅱ.向滤液中加入一定量石灰水,调节溶液![]() ,同时鼓入足量的空气。
,同时鼓入足量的空气。
已知:Ksp[Fe(OH)3]=4×10-38,回答下列问题:
(1)![]() 蚀刻铜箔反应的离子方程式为______;过程Ⅰ加入铁屑的主要作用是______
蚀刻铜箔反应的离子方程式为______;过程Ⅰ加入铁屑的主要作用是______
(2)过程Ⅱ中鼓入足量的空气发生反应的化学方程式为______
(3)过程Ⅱ中调节溶液的![]() 为5,金属离子浓度为______。(列式计算)
为5,金属离子浓度为______。(列式计算)
(4)另一兴趣小组将制造印刷电路板![]() 蚀刻铜箔的反应设计成一个原电池。请将方框中实验装置图补充完整,并作相应标注(标出电极材料、电解质溶液)。限选材料:
蚀刻铜箔的反应设计成一个原电池。请将方框中实验装置图补充完整,并作相应标注(标出电极材料、电解质溶液)。限选材料:![]() ,
,![]() ,
,![]() ,
,![]() :铜片,铁片,锌片,石墨和导线。
:铜片,铁片,锌片,石墨和导线。

(5)废旧印刷电路板经粉碎分离能得到非金属粉末和金属粉末,也可回收利用实现资源再生,减少污染。印刷电路板的金属粉末用![]()
![]() 和
和![]()
![]() 的混合溶液处理,溶出印刷电路板金属粉末中的铜。控制其他条件相同时,测得不同温下铜的平均溶解速率(见下表)。
的混合溶液处理,溶出印刷电路板金属粉末中的铜。控制其他条件相同时,测得不同温下铜的平均溶解速率(见下表)。
温度 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率 |
|
|
|
|
|
|
|
①当温度高于![]() 时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______。
时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______。
②在提纯后的![]() 溶液中加入一定量的
溶液中加入一定量的![]() 和
和![]() 溶液,加热,生成
溶液,加热,生成![]() 沉淀。制备
沉淀。制备![]() 的离子方程式是______。
的离子方程式是______。