��Ŀ����
����Ŀ�����ӹ�ҵ��ʹ��![]() ��Һʴ��ͭ������ӡˢ��·�塣�ڸ��Ʊ������У�Ϊ��ʵ����Դ������������Ⱦ��ij��ȤС�������Һ��������Դ���յĹ������£�
��Һʴ��ͭ������ӡˢ��·�塣�ڸ��Ʊ������У�Ϊ��ʵ����Դ������������Ⱦ��ij��ȤС�������Һ��������Դ���յĹ������£�
��.���Һ��Ͷ�������м����ַ�Ӧ�������������Һ��
��.����Һ�м���һ����ʯ��ˮ��������Һ![]() ��ͬʱ���������Ŀ�����
��ͬʱ���������Ŀ�����
��֪��Ksp[Fe(OH)3]=4��10-38���ش��������⣺
��1��![]() ʴ��ͭ����Ӧ�����ӷ���ʽΪ______��������������м����Ҫ������______
ʴ��ͭ����Ӧ�����ӷ���ʽΪ______��������������м����Ҫ������______
��2���������й��������Ŀ���������Ӧ�Ļ�ѧ����ʽΪ______
��3���������е�����Һ��![]() Ϊ5����������Ũ��Ϊ______������ʽ���㣩
Ϊ5����������Ũ��Ϊ______������ʽ���㣩
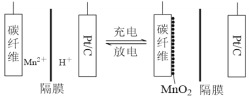
��4����һ��ȤС�齫����ӡˢ��·��![]() ʴ��ͭ���ķ�Ӧ��Ƴ�һ��ԭ��ء��뽫������ʵ��װ��ͼ����������������Ӧ��ע������缫���ϡ��������Һ������ѡ���ϣ�
ʴ��ͭ���ķ�Ӧ��Ƴ�һ��ԭ��ء��뽫������ʵ��װ��ͼ����������������Ӧ��ע������缫���ϡ��������Һ������ѡ���ϣ�![]() ��
��![]() ��
��![]() ��
��![]() ��ͭƬ����Ƭ��пƬ��ʯī�͵��ߡ�
��ͭƬ����Ƭ��пƬ��ʯī�͵��ߡ�
��5���Ͼ�ӡˢ��·�徭��������ܵõ��ǽ�����ĩ�ͽ�����ĩ��Ҳ�ɻ�������ʵ����Դ������������Ⱦ��ӡˢ��·��Ľ�����ĩ��![]()
![]() ��
��![]()
![]() �Ļ����Һ�������ܳ�ӡˢ��·�������ĩ�е�ͭ����������������ͬʱ����ò�ͬ����ͭ��ƽ���ܽ����ʣ����±�����
�Ļ����Һ�������ܳ�ӡˢ��·�������ĩ�е�ͭ����������������ͬʱ����ò�ͬ����ͭ��ƽ���ܽ����ʣ����±�����
�¶� | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
ͭƽ���ܽ����� |
|
|
|
|
|
|
|
�����¶ȸ���![]() ʱ��ͭ��ƽ���ܽ��������ŷ�Ӧ�¶����߶��½�������Ҫԭ����______��
ʱ��ͭ��ƽ���ܽ��������ŷ�Ӧ�¶����߶��½�������Ҫԭ����______��
�����ᴿ���![]() ��Һ�м���һ������
��Һ�м���һ������![]() ��
��![]() ��Һ�����ȣ�����
��Һ�����ȣ�����![]() �������Ʊ�
�������Ʊ�![]() �����ӷ���ʽ��______��
�����ӷ���ʽ��______��
���𰸡�2Fe3++Cu=2Fe2++Cu2+ ���ս���ͭ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 c(Fe3+)=Ksp[Fe(OH)3]/c3(OH-)=4��10-38/10-27=4��10-11 mol/L 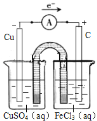 ˫��ˮ�ֽ����ʼӿ� 2Cu2++2Cl-+SO32-+H2O=2CuCl��+SO42-+2H+
˫��ˮ�ֽ����ʼӿ� 2Cu2++2Cl-+SO32-+H2O=2CuCl��+SO42-+2H+
��������
��1�������Ӻ�ͭ����������ԭ��Ӧ���ݴ�д����Ӧ�����ӷ���ʽ����Һ�����������Ӻ�ͭ���ӵȣ�������������м�ѷ�Һ�е�ͭ�����û����������ս���ͭ��
��2�������������ױ������е����������������������ݴ�д����Ӧ�ķ���ʽ��
��3��pH=5��c(H+)=10-5mol/L��c(OH-)=10-9mol/L������Ksp[Fe(OH)3]=c3(OH-)��c(Fe3+)������ֵ���м��㣻
��4��2FeCl3+Cu=2FeCl2+CuCl2���÷�ӦΪ������ԭ��Ӧ��ʯī���������ϣ��Ȼ���������������ԭ��Ӧ��ͭ�ڸ�������������Ӧ���������ҺΪ����ͭ���ݴ����װ��ͼ��
��5�����¶ȹ��ߣ�˫��ˮ�ֽ����ʼӿ���
�����������Ϣд�÷�Ӧ�����ӷ���ʽ��
��1�������Ӻ�ͭ����������ԭ��Ӧ�����ӷ���ʽΪ��2Fe3++Cu=2Fe2++Cu2+����Һ�����������Ӻ�ͭ���ӵȣ�������������м�ѷ�Һ�е�ͭ�����û����������ս���ͭ��
�������������������2Fe3++Cu=2Fe2++Cu2+�����ս���ͭ��
��2����Һ�е�����������OH-��Ӧ�����������������������������ױ������е������������������������Թ������й��������Ŀ���������Ӧ�Ļ�ѧ����ʽ:4Fe(OH)2+O2+2H2O=4Fe(OH)3��
����������������ǣ�4Fe(OH)2+O2+2H2O=4Fe(OH)3��
��3��pH=5��c(H+)=10-5mol/L��c(OH-)=10-9mol/L������Ksp[Fe(OH)3]=c3(OH-)��c(Fe3+)=4��10-38��c(Fe3+)= Ksp[Fe(OH)3]/ c3(OH-)=4��10-38/10-27=4��10-11 mol/L��
����������������ǣ�c(Fe3+)=Ksp[Fe(OH)3]/c3(OH-)=4��10-38/10-27=4��10-11 mol/L ��
��4��2FeCl3+Cu= 2FeCl2+CuCl2,�÷�ӦΪ������ԭ��Ӧ���Ȼ���������ԭ��Ӧ��ͭ����������Ӧ����ˣ�����ͼʾװ�ÿ�֪������ձ���������ͭ��Һ���缫Ϊͭ��ͭ�ڴ˼�����������Ӧ��Cu��2e��=Cu2+ ���������ҺΪ����ͭ���Ҳ��ձ��м����Ȼ�����Һ���缫����Ϊʯī���������ҺΪ�Ȼ������������ڴ˼��õ��ӻ�ԭΪ�������ӣ�����ӦΪ��Fe3++e��=Fe2+����װ��ͼ���£�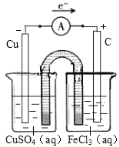 ��
��
����������������ǣ�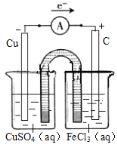 ��
��
��5���ٸ��ݲ�ò�ͬ�¶���ͭ��ƽ���ܽ����ʵ����ݣ��ᷢ�������¶ȵ����ߣ�ͭ��ƽ���ܽ����ʣ����¶ȸ���40��ʱ��ͭ��ƽ���ܽ��������ŷ�Ӧ�¶����߶��½�����Ϊ˫��ˮ�����ֽ⣬���½���ͭ�ķ�Ӧ���ʼ�����
�������������������˫��ˮ�ֽ����ʼӿ���
�ڸ��������Ϣ��֪�÷�Ӧ�����ӷ���ʽ����2Cu2++2Cl-+SO32-+H2O=2CuCl��+SO42-+2H+��
��������������ǣ�2Cu2++2Cl-+SO32-+H2O=2CuCl��+SO42-+2H+��