题目内容
(9分)硝矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O及少量氧化铁。
利用明矾石制备K2SO4的工艺流程如下所示: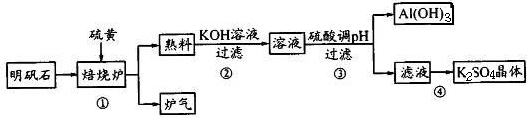
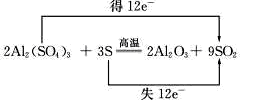
(1)焙烧炉中发生如下反应,请在方程式中表示出电子转移的方向和数目
2Al2(SO4)3+3S 2Al2O3+9SO2↑
2Al2O3+9SO2↑
(2)步骤②涉及Al2O3的离子方程式为____。
(3)步骤③调pH生成AI{OH)。的离子方程式为____;不能用CO2来调pH,理由是
.
(4)步骤④的主要操作步骤是___ _,过滤、洗涤和干燥
(5)炉气回收可做多种用途,请举一例:__ _。
(1) ;
;
(2)Al 2O3+2 OH-=2AlO2-+H2O
(3)AlO2-+H++ H2O=Al(OH)3↓ 最后制得的K2SO4晶体会含有碳酸钾、碳酸氢钾等杂质;
(4)蒸发结晶
(5)可作工业生产硫酸的原料(或用作还原剂与其他氧化剂反应制备所需物质等)
解析试题分析:(1)反应物Al2(SO4)3中S元素的化合价降低,共得到12e-,单质S的化合价升高,共失去12个12e-,双线桥表示如下 ;
;
(2)氧化铝与氢氧化钾溶液反应生成偏铝酸钾和水,离子方程式是Al 2O3+2 OH-=2AlO2-+H2O;
(3)AlO2-与酸反应生成氢氧化铝沉淀,离子方程式为AlO2-+H++ H2O=Al(OH)3↓;若用二氧化碳调节pH,反应中有碳酸根离子或碳酸氢根离子生成,给制备硫酸钾晶体带来杂质;
(4)由溶液制备晶体的第一步是蒸发结晶,然后过滤、洗涤、干燥得产品;
(5)炉气的主要成分是二氧化硫,可用于制造硫酸的原料,或用作还原剂等。
考点:考查工业制备流程的分析,基本实验操作,氧化还原反应的表示

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案金属钠长期露置在空气中,最后转变为( )
| A.Na2CO3 | B.Na2O2 | C.NaOH | D.Na2O |
下列化学实验事实及其解释不正确的是
| A.滴有酚酞的NaHCO3溶液呈浅红色,微热后红色加深,是因为NaHCO3分解生成了Na2CO3 |
| B.钠保存在煤油中,是因为煤油不与钠反应,且钠比煤油密度大、煤油可以隔绝空气 |
| C.用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应 |
| D.钠长期暴露在空气中的产物是Na2CO3,原因是钠在空气中生成的Na2O会与水和二氧化碳反应 |
利用下图装置做铝热反应实验。下列说法不正确的是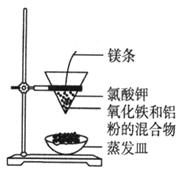
A.该反应的化学方程式是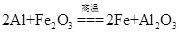 |
| B.该反应会产生高温、发出强光 |
| C.根据铝热反应的原理,可以冶炼某些金属 |
| D.若反应中转移3 mol电子,则消耗氧化剂的物质的量是1 mol |