题目内容
利用下图装置做铝热反应实验。下列说法不正确的是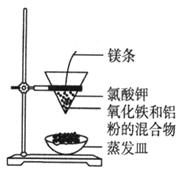
A.该反应的化学方程式是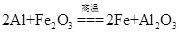 |
| B.该反应会产生高温、发出强光 |
| C.根据铝热反应的原理,可以冶炼某些金属 |
| D.若反应中转移3 mol电子,则消耗氧化剂的物质的量是1 mol |
D
解析试题分析:A、Al与Fe2O3在高温条件下反应,生成Fe和Al2O3,正确;B、铝热反应会放出大量的热,产生高温、发出强光,正确;C、铝热反应可以生成金属单质,利用铝热反应可冶炼某些金属,正确;D、铁元素的化合价从+3价降低到0价,因此1mol氧化铁在反应中得到6mol电子,若反应中转移3 mol电子,则消耗氧化剂的物质的量是0.5 mol,错误。
考点:本题考查铝热反应的有关判断和计算。

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
Mg、Al两种金属分别跟同体积、同浓度的稀H2SO4反应,同温同压下生成氢气的体积相同,则Mg、Al两种金属之间的量的关系一定正确的是
| A.两个反应电子转移的数目相等 | B.加入镁、铝质量比为4∶3 |
| C.金属溶解的物质的量相等 | D.加入的两种金属质量不等 |
取等质量的钠进行下列实验,其中生成氢气最多的是
| A.将钠投入足量的水中 |
| B.将钠投入足量的稀硫酸中 |
| C.将钠用铝箔包好并刺一些小孔,再放入足量的水中 |
| D.将钠用耐热塑料薄膜包好并刺一些小孔,再放入足量的水中 |
FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,下列判断不正确的是
| A.加入KSCN溶液一定不变红色 |
| B.溶液中一定含Fe2+ |
| C.溶液中一定含Cu2+ |
| D.剩余固体中一定含铜 |
有铁的氧化物样品,用140ml0.5mol/L的盐酸恰好使其完全溶解,所得溶液还能吸收标准状况下氯气56ml,使其中的Fe2+全部转化为Fe3+,该样品可能的化学式是( )
| A.Fe2O3 | B.Fe3O4 | C.Fe5O7 | D.Fe4O5 |
 2Al2O3+9SO2↑
2Al2O3+9SO2↑
 2LiH Ⅱ.LiH+H2O=LiOH+H2↑
2LiH Ⅱ.LiH+H2O=LiOH+H2↑