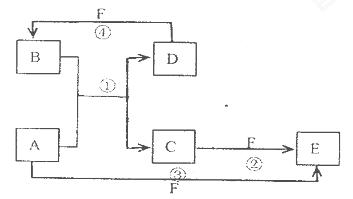
题目内容
化合物甲是由短周期元素组成的陶瓷材料,是一种以共价键相连的物质,具有耐高温、抗冲击、导热性好等优良性质。乙是制备这种材料的起始原料,也是铝土矿的主要成分。制备时采取碳热还原氮化法,即把乙与炭粉按一定比例混合,在流动N2气氛中加热到一定温度即可得到甲和可燃性气体丙,二者原子个数之比均为1:1。8.2g甲与足量的氢氧化钠溶液混合可以得到无色溶液丁,并产生标准状况下4.48L气体戊。
(1)乙的化学式为 ,写出它的一种用途 。
(2)甲的晶体类型为 ,写出碳热还原氮化法制甲的化学方程式 。
(3)工业制备甲的过程中可能含有的杂质有 。
(4)气体戊的结构式为 ,写出甲与足量的氢氧化钠溶液反应的化学方程式为 ,验证溶液丁中溶质的实验方法为 。
(1)Al2O3 耐高温材料(其他合理均可)
(2) 原子晶体 Al2O3 + 3C +N2 =2AlN + 3CO
(3) Al2O3 C Al4C3等
(4)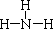 AlN + NaOH +H2O=NaAlO2 + NH3 取少量溶液丁于试管中,逐滴加入稀盐酸,若先产生白色沉淀后消失,说明为NaAlO2。
AlN + NaOH +H2O=NaAlO2 + NH3 取少量溶液丁于试管中,逐滴加入稀盐酸,若先产生白色沉淀后消失,说明为NaAlO2。
解析试题分析;据题意可知甲物质为二氧化硅,乙物质为氧化铝。二氧化硅为原子晶体。氧化硅与碳在氮气条件下,高温加热,可生成可燃性气体一氧化碳,。所以Al2O3 + 3C +N2 =2AlN + 3CO 。而AlN + NaOH +H2O=NaAlO2 + NH3。,检验NaAlO2的方法是取少量溶液丁于试管中,逐滴加入稀盐酸,若先产生白色沉淀后消失,说明为NaAlO2。主要是利用偏铝酸根离子在酸性条件下可转化为氢氧化铝,而氢氧化铝又溶于强酸的这个性质。
考点:考查金属元素铝及其化合物的相关知识点

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案关于金属铝和铁的说法不正确的是
| A.铁与热水不反应,但是可与水蒸气发生置换反应 |
| B.铝箔在空气中受热可以熔化,剧烈燃烧,产生大量的热 |
| C.常温下,可以用铝或铁制容器来盛装冷的浓硫酸或冷的浓硝酸 |
| D.铝元素是地壳中含量最多的金属元素,而铁是用途最广的金属 |
FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,下列判断不正确的是
| A.加入KSCN溶液一定不变红色 |
| B.溶液中一定含Fe2+ |
| C.溶液中一定含Cu2+ |
| D.剩余固体中一定含铜 |
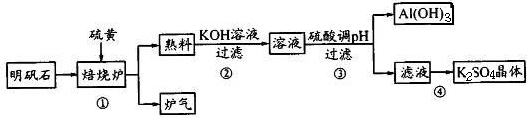
 2Al2O3+9SO2↑
2Al2O3+9SO2↑
 2LiH Ⅱ.LiH+H2O=LiOH+H2↑
2LiH Ⅱ.LiH+H2O=LiOH+H2↑