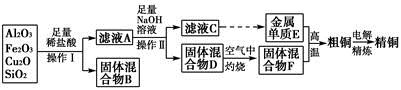
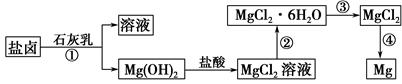
题目内容
镁、铝、铁及其化合物在生产、生活中有着广泛的应用
I:实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下: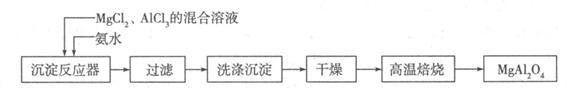
(1)已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34,该温度下向浓度均为0.01 mol·L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成 沉淀(填化学式)。
(2)高温焙烧时发生反应的化学方程式 ,洗涤沉淀时的方法是 。
(3)常温下如果向AlCl3饱和溶液中不断通人HCl气体,可析出AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因: 。
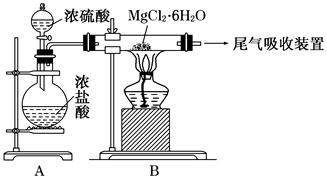
Ⅱ:某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。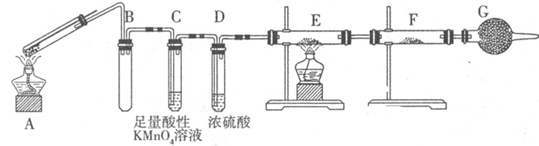
(1)G装置的作用是 。
(2)证明有SO2生成的现象是 ,为了证明气体中含有氢气,装置E和F中加入的试剂分别为 、 。
(3)若将铁丝换成铜丝,反应后的溶液没有出现预计的蓝色溶液,而出现了大量白色固体,原因是 。
I(1)Al(OH)3
(2)2Al(OH)3+Mg(OH)2=MgAl2O4+4H2O (2分) 向置于过滤器上的沉淀加蒸馏水至完全没过沉淀,待其自然流尽后,重复二到三次即可(2分)
(3)AlCl3饱和溶液中存在溶解平衡:AlCl3?6H2O(s) Al3+(aq)+3Cl?(aq)+6H2O(l),通入HCl气体使溶液中c(Cl?)增大,平衡向析出固体的方向移动从而析出AlCl3?6H2O晶体。(3分)
Al3+(aq)+3Cl?(aq)+6H2O(l),通入HCl气体使溶液中c(Cl?)增大,平衡向析出固体的方向移动从而析出AlCl3?6H2O晶体。(3分)
II(1)防止空气中的H2O进入F(2分)
(2)酸性高锰酸钾溶液褪色(2分) CuO、CuSO4(各1分)
(3)浓硫酸中的水很少(2分)
解析试题分析:I(1)根据Ksp[Mg(OH)2]可求出Mg2+再转化为Mg(OH)2沉淀OH?浓度,c(Mg2+)?c2(OH?)=1.8×10-11,因为c(Mg2+)=1/2c(OH?),则1/2c3(OH?)=1.8×10-11, Ksp[Al(OH)3]="1/3" c4(OH?)=3×10-34,比较可得恰好生成Al(OH)3时,OH?浓度小,所以先生成Al(OH)3沉淀。
(2)根据流程图,高温焙烧时的反应物为Mg(OH)2和Al(OH)3,生成物为MgAl2O4和4H2O,配平可得化学方程式:2Al(OH)3+Mg(OH)2=MgAl2O4+4H2O;沉淀洗涤的方法为:向置于过滤器上的沉淀加蒸馏水至完全没过沉淀,待其自然流尽后,重复二到三次即可。
(3)AlCl3饱和溶液中存在沉淀溶解平衡:AlCl3?6H2O(s) Al3+(aq)+3Cl?(aq)+6H2O(l),通入HCl气体使溶液中c(Cl?)增大,平衡向析出固体的方向移动从而析出AlCl3?6H2O晶体。
Al3+(aq)+3Cl?(aq)+6H2O(l),通入HCl气体使溶液中c(Cl?)增大,平衡向析出固体的方向移动从而析出AlCl3?6H2O晶体。
II(1)因为该实验要检验是否有H2O生成,所以装置G盛放物质为碱石灰,作用是防止空气中的H2O进入F。
(2)SO2具有还原性,能被酸性KMnO4溶液氧化,所以证明有SO2生成的现象是酸性高锰酸钾溶液褪色;为了证明气体中含有氢气,装置E和F中加入的试剂分别为CuO、CuSO4,若含有H2,H2可把CuO还原为Cu,生成的H2O能与CuSO4反应生成蓝色的CuSO4?5H2O。
(3)浓硫酸中的水很少,CuSO4没有溶解,以CuSO4固体的形式存在,为白色。
考点:本题考查化学流程的分析、化学方程式的书写、沉淀溶解平衡、化学实验方案的分析。

 备战中考寒假系列答案
备战中考寒假系列答案钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。
(1)Al(NO3)3是制备钠硫电池部件的原料之一。由于Al(NO3)3容易吸收环境中的水分,需要对其进行定量分析。具体步骤如下图所示: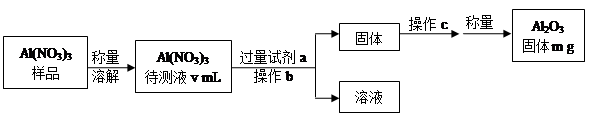
①加入试剂a后发生反应的离子方程式为 。
②操作b为 ,操作c为 。
③Al(NO3)3待测液中,c (Al3+) = mol·L-1(用m、v表示)。
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示: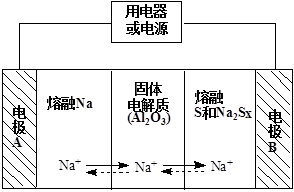
①根据下表数据,请你判断该电池工作的适宜温度应控制在 范围内(填字母序号)。
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
a.100℃以下 b.100℃~300℃ c.300℃~350℃ d.350℃~2050℃
②放电时,电极A为 极。
③放电时,内电路中Na+的移动方向为 (填“从A到B”或“从B到A”)。
④充电时,总反应为Na2Sx="2Na" + xS(3<x<5),则阳极的电极反应式为 。
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示: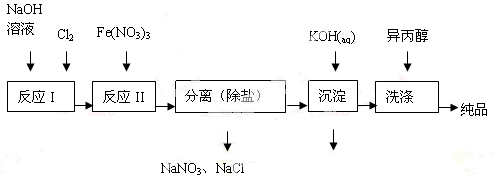
①洗涤粗品时选用异丙醇而不用水的理由是 。
②反应II的离子方程式为 。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂,它能消毒杀菌是因为 它能净水的原因是 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液c(Fe3+)=4.0×10-5mol/L,则需要调整到 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
(4)高铁电池是正在研制中的可充电干电池,高铁电池具有工作电压稳定,放电时间长等优点,有人以高铁酸钾、二氧化硫和三氧化硫原料,以硫酸酸钾为电解质,用惰性电极设计成高温下使用的电池,写出该电池正极电极反应式 。
 2Al2O3+9SO2↑
2Al2O3+9SO2↑