题目内容
9.NA代表阿伏加德罗常数值,下列说法正确的是( )| A. | 78gNa2O2所含有的离子数为3NA | |
| B. | 1mol甲基中含有电子数为10NA | |
| C. | 7.1g氯气与足量NaOH溶液反应转移的电子数为0.2NA | |
| D. | 1molC10H22分子中共价键总数为22NA |
分析 A.1mol过氧化钠中含有2mol钠离子和1mol过氧根离子;
B.甲基为中性原子团,甲基中含有9个电子;
C.氯气与强氧化钠溶液的反应中,氯气既是氧化剂也是还原剂,0.1mol氯气完全反应转移了0.1mol电子;
D.C10H22分子中含有9个碳碳键、22个碳氢键,总共含有31g共价键.
解答 解:A.Na2O2所含有的离子为Na+及过氧根离子,个数比2:1,故78gNa2O2的物质的量为1mol,所含有的离子数为3NA,故A正确;
B.甲基为中性原子团,11mol甲基含有9mol电子,故1mol甲基中含有电子数为9NA,故B错误;
C.氯气与碱液发生的是自身氧化还原反应:Cl2+2NaOH=NaCl+NaClO+H2O,只有一个电子转移,7.1g氯气的物质的量为0.1mol,0.1mol氯气与足量NaOH溶液反应转移的电子数为0.1NA,故C错误;
D.1molC10H22分子中含有9mol碳碳键、22mol碳氢键,总共含有31mol共价键,共价键总数为31NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度中等,注意掌握物质的量浓度与阿伏伽德罗常数、摩尔质量等物理量之间的转化关系,明确过氧化钠中的离子构成情况,B为易错点,注意甲基与甲烷、氢氧根离子与羟基的区别.

练习册系列答案
相关题目
12.不论以何种比例混合,只要混合物的质量一定,完全燃烧后生成CO2的量也一定的是( )
| A. | 乙烯和丙烯 | B. | 甲烷和乙烯 | C. | 甲苯和乙苯 | D. | 乙炔和苯 |
17.下列各组离子能同时大量共存的是( )
| A. | Na+、HS-、H+、Cl- | B. | HS-、Na+、OH-、K+ | ||
| C. | K+、CO32-、Br-、AlO2- | D. | H+、Cl-、Na+、SO32- |
4. 如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥品红试纸c不褪色;若关闭活塞b,则c不久褪色.则a溶液是( )
如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥品红试纸c不褪色;若关闭活塞b,则c不久褪色.则a溶液是( )
 如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥品红试纸c不褪色;若关闭活塞b,则c不久褪色.则a溶液是( )
如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥品红试纸c不褪色;若关闭活塞b,则c不久褪色.则a溶液是( )| A. | 浓盐酸 | B. | 浓硫酸 | C. | 饱和食盐水 | D. | NaOH溶液 |
15.下列物质中,互为同位素的是( )
| A. | H2O与D2O | B. | ${\;}_8^{16}O$与${\;}_8^{18}O$ | ||
| C. | 红磷和白磷 | D. | ${\;}_{6}^{12}$C与C60 |
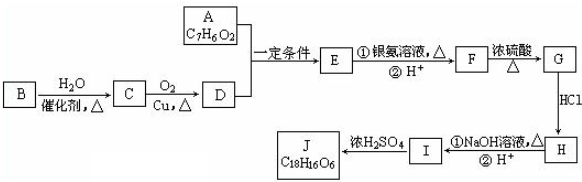

 .
.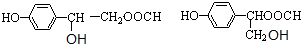 、
、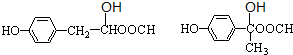 .
.