题目内容
14.(1)现有4种有机物:①甲烷、②乙烯、③苯、④乙醇.其中,属于天然气主要成分的是①(填序号);属于烃并能使酸性高锰酸钾溶液褪色的是②(填序号); 能与乙酸发生酯化反应的是④(填序号),其化学方程式为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;苯在FeBr3催化作用下,能与溴反应生成溴苯,其化学方程式为C6H6+Br2$\stackrel{Fe}{→}$C6H5Br+HBr,该反应的反应类型是取代反应.(2)现了解到乙醇的性质有:①能与酸性重铬酸钾溶液反应、②能使蛋白质变性、③能做溶剂、④易挥发.其中,可用于检查司机是否酒后驾车的是①,可用酒精消毒的原因是②,可用酒精制碘酒溶液的原因是③,可用酒精给发烧病人物理降温的原因是④.
(3)乙醇和乙酸中官能团的名称分别是羟基、羧基,由乙烯制取乙醇的反应类型是加成反应,写出乙醇制取乙醛的化学方程式2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.
分析 (1)天然气的主要成分是甲烷,乙烯中含有碳碳双键,能使高锰酸钾溶液褪色,乙醇与乙酸发生酯化反应制取乙酸乙酯,苯与液溴发生取代反应生成溴苯;
(2)乙醇与酸性重铬酸钾溶液反应使其变色,常用于检测酒驾,酒精能使蛋白质变性,常用于消毒,酒精是很好的有机溶剂,常用于制取碘酒,酒精具有挥发性,能带走部分热量,据此解答即可;
(3)乙醇中含有-OH,乙酸中含有-COOH,乙烯与水加成生成乙醇,乙醇氧化生成乙醛,据此解答即可.
解答 解:(1)天然气的主要成分是甲烷,乙烯能使高锰酸钾溶液褪色,乙醇能与乙酸反应生成乙酸乙酯,化学反应方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,在催化剂的作用下,苯环上的氢原子被溴原子所取代,生成溴苯,同时有溴化氢生成:C6H6+Br2$\stackrel{Fe}{→}$C6H5Br+HBr,属于取代反应,故答案为:①;②;④;CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;C6H6+Br2$\stackrel{Fe}{→}$C6H5Br+HBr;取代反应;
(2)乙醇具有还原性,能与酸性重铬酸钾溶液反应使其变色,常用于检测酒驾;酒精常用于消毒的原因是酒精能使蛋白质变性;由于酒精是很好的有机溶剂,常用于制取碘酒;因为酒精具有挥发性,能带走部分热量,故常用于给发烧病人物理降温,故答案为:①②③④;
(3)乙醇中含有-OH,名称为羟基,乙酸中含有官能团-COOH,名称为羧基,乙烯与水发生加成反应生成乙醇,乙醇在催化剂存在条件下与氧气反应生成乙醛的化学方程式为:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O,
故答案为:羟基;羧基;加成反应;2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.
点评 本题综合考查的是常见有机物的性质、乙醇的性质、有机化学反应方程式的书写,化学反应类型的判断等,难度不大.

| A. | 氧化亚铁和稀硝酸反应FeO+2H+═Fe2++H2O | |
| B. | 硫酸铝溶液与足量烧碱:Al3++3OH-=Al(OH)3↓ | |
| C. | 氯化亚铁溶液中滴入氯水Cl2+2Fe2+═2Cl-+2Fe3+ | |
| D. | 金属铝投入NaOH溶液中2Al+2OH-+2H2O═2AlO${\;}_{2}^{-}$+2H2↑ |
| A. | 78gNa2O2所含有的离子数为3NA | |
| B. | 1mol甲基中含有电子数为10NA | |
| C. | 7.1g氯气与足量NaOH溶液反应转移的电子数为0.2NA | |
| D. | 1molC10H22分子中共价键总数为22NA |
| A. | Na2S溶液中加入少量FeCl3溶液:2Fe3++S2-═2Fe2++S↓ | |
| B. | 向NaOH溶液中滴加碳酸氢钙溶液至OH-恰好完全反应:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| C. | 向NaClO溶液中通入少量SO2气体:ClO-+SO2+H2O═SO42-+Cl-+2H+ | |
| D. | Na2CO3溶液中滴入少量邻羟基苯甲酸溶液: +CO32-→ +CO32-→ +HCO3- +HCO3- |
| A. | 中子数为20的氯原子:37Cl | B. | Cl-的结构示意图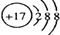 | ||
| C. | 氢氧根离子的电子式: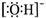 | D. | HClO的结构式 H-Cl-O |
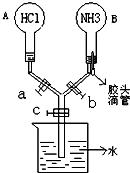 如图所示的装置,实验前a、b、c活塞均关闭.
如图所示的装置,实验前a、b、c活塞均关闭.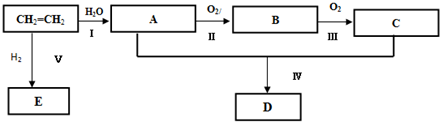
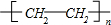 ;反应类型:加聚反应
;反应类型:加聚反应