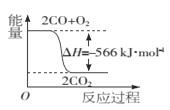
题目内容
【题目】世界上最早发现并使用锌的是中国,明朝末年《天工开物》一书中有世界上最早的关于炼锌技术的记载。回答下列问题:
(1)基态Zn原子的核外电子所占据的最高能层符号为___。
(2)硫酸锌溶于过量的氨水可形成[Zn(NH3)4]SO4溶液。
①[Zn(NH3)4]SO4中阴离子的空间构型为_______。
②![]() 中,中心原子的轨道杂化类型为________。
中,中心原子的轨道杂化类型为________。
③写出一种与![]() 互为等电子体的分子的化学式:________。
互为等电子体的分子的化学式:________。
④NH3极易溶于水,除因为它们都是极性分子外,还因为________
【答案】N 正四面体 sp3 CCl4(或SiCl4、SiF4) NH3与H2O之间可形成分子间氢键,NH3与H2O发生反应
【解析】
(1)Zn为30号元素,基态Zn原子的价层电子排布为3d104s2,占据最高能层为第4层,能层符号为N;
(2)①[Zn(NH3)4]SO4中阴离子为![]() ,其中心原子价层电子对数为
,其中心原子价层电子对数为![]() =4,不含孤电子对,空间构型为正四面体形;
=4,不含孤电子对,空间构型为正四面体形;
②![]() 中,中心原子的价层电子对数为4,所以为sp3杂化;
中,中心原子的价层电子对数为4,所以为sp3杂化;
③![]() 含有5个原子,价电子总数为32,与其互为等电子的分子有CCl4、SiCl4、SiF4等;
含有5个原子,价电子总数为32,与其互为等电子的分子有CCl4、SiCl4、SiF4等;
④NH3与H2O之间可形成分子间氢键,NH3与H2O发生反应,也使氨气极易溶于水。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】往2L密闭容器中充入NO2,在三种不同条件下发生反应:2NO2(g)2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表![]() 不考虑生成N2O4)
不考虑生成N2O4)
0 | 10 | 20 | 30 | 40 | 50 | |
实验1/800 | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
实验2/800 | 1.00 | 0.70 | 0.50 | 0.50 | 0.50 | 0.50 |
实验3/850 | 1.00 | 0.50 | 0.40 | 0.15 | 0.15 | 0.15 |
下列说法正确的是( )
A.实验2比实验1的反应容器内压强减小
B.实验2比实验l使用了效率更高的催化剂
C.实验1比实验3的平衡常数大
D.实验2和实验3可判断该反应是放热反应
【题目】实验室中用氯气与粗铜![]() 杂质只有Fe)反应,制备CuCl2·2H2O晶体的流程如下
杂质只有Fe)反应,制备CuCl2·2H2O晶体的流程如下

已知:氯化铜从水溶液中结晶时,所得晶体CuCl2·2H2O与温度关系如下
温度 | 小于15℃ | 15—25.7℃ | 26—42℃ | 42—100℃ | 100℃以上 |
晶体 | CuCl2·4H2O | CuCl2·3H2O | CuCl2·2H2O | CuCl2·H2O | CuCl2 |
下列说法不正确的是
A.制备氯气的反应:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
B.由溶液乙制备纯净CuCl2·2H2O晶体的系列操作步骤为:加少量盐酸、蒸发浓缩、冷却到室温结晶、过滤、洗涤、干燥。
C.固体乙是氢氧化铁
D.此流程中溶解固体甲的酸只能是盐酸