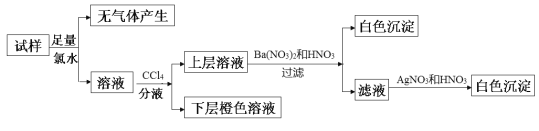
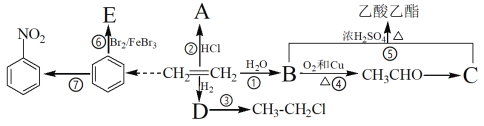
题目内容
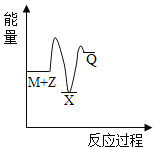
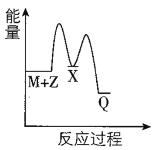
【题目】煤的工业加工过程中,可利用CO和H2合成甲醇,能量变化如图所示。下列说法正确的是
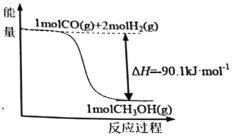
A.该反应是吸热反应
B.1molCH3OH所具有的能量为90.1kJ
C.CO(g)+2H2(g)![]() CH3OH(l) ΔH=-90.1kJ·mol-1
CH3OH(l) ΔH=-90.1kJ·mol-1
D.1molCO和2molH2断键所需能量小于1molCH3OH断键所需能量
【答案】D
【解析】
A. 如图所示,反应物总能量高于生成物总能量,则该反应是放热反应,故A错误;
B. 90.1kJ是反应释放的能量,而非甲醇具有的能量,故B错误;
C. 图中甲醇为气态,所以应该为:CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.1kJ·mol-1,故C错误;
CH3OH(g) ΔH=-90.1kJ·mol-1,故C错误;
D. 该反应为放热反应,所以1molCO和2molH2断键所需能量小于1molCH3OH断键所需能量,故D正确;
故选D。

练习册系列答案
相关题目