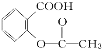
题目内容
【题目】设NA为阿伏加德罗常数的值。关于常温下pH=2的H2C2O4溶液,下列说法正确的是( )
A. 1L溶液中的H+数目为0.02NA
B. 加入NaHC2O4固体,溶液酸性增强
C. c(H+)-c(OH-)=c(HC2O4-)+2c(C2O42-)
D. 加水稀释,溶液中所有离子浓度均减小
【答案】C
【解析】
A.pH=2的H2C2O4溶液中,c(H+)=0.01mol/L,1L溶液中n(H+)=0.01mol,H+数目为0.01NA故A错误。
B.加入NaHC2O4固体,导致c(HC2O4-)增大,使H2C2O4![]() H++ HC2O4-逆向移动,溶液酸性减弱,故B错误。
H++ HC2O4-逆向移动,溶液酸性减弱,故B错误。
C.依据H2C2O4溶液中的电荷守恒可知C正确。
D.加水稀释H2C2O4的浓度减小,其电离度增大,但溶液中氢离子浓度减小,c(OH-)增大,故D错误。
答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】下表中阿拉伯数字(1、2…)是元素周期表中行或列的序号。请参照元素A~I在周期表中的位置,回答下列问题。
1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 | |
1 | A | |||||||
2 | B | C | D | E | ||||
3 | F | G | H | I |
(1)B、C两元素中非金属性较强的是________(写出元素名称),I元素在周期表中的位置是__________。
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式_________。
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1∶1和1∶2的两种共价化合物X和Y,请写出Y的电子式_________,该元素还能与A~I中的另一种元素以原子个数之比为1∶1和1∶2形成两种离子化合物Z和M,用电子式表示M的形成过程:____。
(4)表中某两种元素的气态单质可以形成燃料电池,其产物清洁无污染,请写出碱性环境中负极反应式____。
【题目】归纳整理是科学学习的重要方法之一。氧族元素的各种性质可归纳整理为如下表所示的表格(部分)。
8O | 16S | 34Se | 52Te | |
单质熔点(℃) | -218.4 | 113 | 450 | |
单质沸点(℃) | -183 | 444.6 | 685 | 989 |
主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
原子半径 | 逐渐增大 | |||
单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
请根据表回答下列问题:
(1)硒的熔点范围可能是___________。
(2)碲的化合价可能有__________。
(3)氢硒酸有较强的________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生反应的化学方程式为_______________。
(4)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:______Al2Te3+______=____Al(OH)3+______H2Te↑