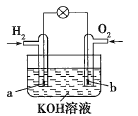
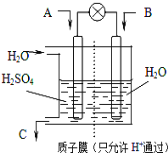
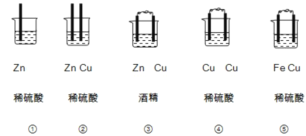
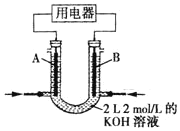
题目内容
【题目】归纳整理是科学学习的重要方法之一。氧族元素的各种性质可归纳整理为如下表所示的表格(部分)。
8O | 16S | 34Se | 52Te | |
单质熔点(℃) | -218.4 | 113 | 450 | |
单质沸点(℃) | -183 | 444.6 | 685 | 989 |
主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
原子半径 | 逐渐增大 | |||
单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
请根据表回答下列问题:
(1)硒的熔点范围可能是___________。
(2)碲的化合价可能有__________。
(3)氢硒酸有较强的________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生反应的化学方程式为_______________。
(4)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:______Al2Te3+______=____Al(OH)3+______H2Te↑
【答案】113℃至450℃之间 -2,+4,+6 还原性 ![]() 1 6H2O 2 3
1 6H2O 2 3
【解析】
(1)由表格可知,氧族元素单质的熔点随原子序数增大呈现增加的趋势,所以Se单质的熔点介于113℃和450℃之间;
(2)Te是非金属元素,通过表格推测,Te元素的常见化合价可能有-2,+4和+6三种;
(3)同主族元素,从上至下非金属性逐渐减弱,对应的简单氢化物稳定性逐渐下降;此外,H2Se中的Se元素为-2价处于最低价态,所以H2Se有较强的还原性;氢硒酸在空气中久置可能会被氧气氧化,相关的方程式为:![]() ;
;
(4)Al2Te3中Te为-2价,反应前后未发生变价,Al为+3价,反应前后也未发生变价;此外,产物中出现H和O元素,因此另一种反应物为H2O,且H和O元素也未在反应过程中发生变价,因此该反应为非氧化还原反应;利用原子守恒对方程式进行配平,该反应的方程式为:![]() 。
。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案