题目内容
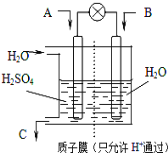
【题目】某化学兴趣小组设计的制取溴苯的实验装置如下图所示:

装置A是酸式滴定管,分液漏斗中是苯和液溴的混合物,打开分液漏斗的活塞,使混合物滴在铁丝上(酸式滴定管活塞关闭)。请回答下列问题:
(1)A选用酸式滴定管而不用碱式滴定管的原因是___________________。
(2)A中反应的化学方程式是________________。
(3)垂直于A的导气管要做得长一些,是为了_________________。
(4)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是______________,反应的化学方程式是___________________。
(5)C中盛放四氯化碳的作用是_______________。
(6)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入硝酸银溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入_____________,现象是________________。
【答案】碱式滴定管的橡皮管,容易被苯和液溴腐蚀 ![]() +Br2
+Br2![]()
![]() +HBr 使挥发逸出的苯和溴蒸气冷凝回流到A中 除去溴苯中溶解的溴 Br2+2NaOH=NaBr+NaBrO+H2O 除去溴化氢气体中的溴蒸气 石蕊溶液 溶液变红色
+HBr 使挥发逸出的苯和溴蒸气冷凝回流到A中 除去溴苯中溶解的溴 Br2+2NaOH=NaBr+NaBrO+H2O 除去溴化氢气体中的溴蒸气 石蕊溶液 溶液变红色
【解析】
(1)碱式滴定管在结构中有橡胶管能被溴腐蚀;
(2)苯可以和溴发生取代反应;
(3)长导管除了导气,还起冷凝回流的作用;
(4)溴能与氢氧化钠反应而溴苯不能;
(5)CCl4 能溶解溴,不能溶解溴化氢;
(6)如果苯和液溴发生的是取代反应,则有HBr生成,如果发生的是加成反应,则无HBr生成,因此要证明苯和液溴发生的是取代反应,而不是加成反应,只需检验有无HBr生成,可以通过检验Br-或H+的方法验证。
(1)橡皮管属有机物且含碳碳双键,苯和液溴都会腐蚀橡皮管,而酸式滴定管是玻璃结构,不会受到腐蚀,故选用酸式滴定管,故答案为:碱式滴定管的橡皮管,容易被苯和液溴腐蚀;
(2)苯和液溴在铁作用下发生取代反应生成溴苯和溴化氢,反应方程式为![]() +Br2
+Br2![]()
![]() +HBr,故答案为:
+HBr,故答案为:![]() +Br2
+Br2![]()
![]() +HBr;
+HBr;
(3)由于该反应放热,且苯和溴两种反应物的沸点都较低,导气管做得长一些利于散热,起冷凝的作用,使挥发逸出的苯和溴蒸气冷凝回流到A中,故答案为:使挥发逸出的苯和溴蒸气冷凝回流到A中;
(4)氯气与NaOH溶液的反应为Cl2+2NaOH═NaCl+NaClO+H2O,因此Br2与NaOH溶液反应的化学方程式为Br2+2NaOH=NaBr+NaBrO+H2O,由此可知实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,可以除去溶于溴苯中的溴,故答案为:除去溴苯中溶解的溴,Br2+2NaOH═NaBr+NaBrO+H2O;
(5)C中盛放四氯化碳能溶解溴,不能溶解溴化氢,故答案为:除去溴化氢气体中的溴蒸气;
(6)如果苯和液溴发生的是取代反应,则有HBr生成,如果发生的是加成反应,则无HBr生成,因此要证明苯和液溴发生的是取代反应,而不是加成反应,只需检验有无HBr生成,可以通过检验Br-或H+的方法验证,可以向试管D中加入硝酸银溶液,若产生淡黄色沉淀,则能证明;另一种验证的方法是向试管D中加入石蕊试液,若溶液变红色,则能证明,故答案为:石蕊试液;溶液变红色。

【题目】温室效应是由于大气里温室气体(二氧化碳、甲烷等)含量增大而形成的。回答下列问题:
(1)利用CO2可以制取甲醇,有关化学反应如下:
①CO2(g)+3H2(g)CH3OH(g)+H2O(g ) ΔH1=-178 kJ·mol-1
②2CO(g)+O2(g)2CO2(g) ΔH2=-566 kJ·mol-1
③2H2(g)+O2(g)2H2O(g) ΔH3=-483.6 kJ·mol-1
已知反应①中相关的化学键键能数据如下:
化学键 | C—C | C—H | H—H | C—O | H—O |
键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 463 |
由此计算断开1 mol C![]() O需要吸收____________kJ的能量。
O需要吸收____________kJ的能量。
(2)甲烷燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示:通入a气体的电极是原电池的______极(填“正”或“负”),其电极反应式为______。

(3)如图是用甲烷燃料电池(电解质溶液为KOH溶液)实现铁上镀铜,则b处通入的是____(填“CH4”或“O2”),电解前,U形管的铜电极、铁电极的质量相等,电解2min后,取出铜电极、铁电极,洗净、烘干、称量,质量差为12.8g,在通电过程中,电路中通过的电子为_____mol,消耗标准状况下CH4______mL.

【题目】煤气中主要的含硫杂质有H2S以及CS2、COS等有机硫,煤气燃烧后含硫杂质会转化成SO2从而引起大气污染。煤气中H2S的脱除程度已成为其洁净度的一个重要指标,脱除煤气中H2S的方法有干法脱硫和湿法脱硫,其中湿法脱硫的原理是利用Na2CO3溶液吸收H2S生成NaHS,再进一步被空气氧化成Na2S2O3。
请回答下列问题:
(1)①Na2S2O3的化学名称为___________。
(2)脱除煤气中COS的方法有Br2的KOH溶液氧化法、H2还原法以及水解法等。
①COS的分子结构与CO2相似,COS的电子式为_____________。
②Br2的KOH溶液将COS氧化为硫酸盐和碳酸盐的离子方程式为___________________;增大压强,COS的转化率_____________(填“提高”、“不变”或“降低”)。
③已知断裂1mol化学键所需的能量如下:
化学键 | H—H | C═O | C═S | H—S |
|
E/kJmol-1 | 436 | 745 | 577 | 339 | 1072 |
H2还原COS发生的反应为H2(g)+COS(g) ═H2S(g)+CO(g),该反应的ΔH=________kJ·mol-1。
④用活性α—Al2O3催化COS水解的反应为COS(g)+ H2 O(g) ![]() CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,在相同的时间内测得不同温度下COS的转化率(未达平衡)如图1所示;某温度下,COS的平衡转化率与
CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,在相同的时间内测得不同温度下COS的转化率(未达平衡)如图1所示;某温度下,COS的平衡转化率与![]() 的关系如图2所示。
的关系如图2所示。


由图1可知,催化剂活性最大时对应的温度约为_______;由图2可知,P点时平衡常数K=____________(保留2位有效数字)。
(3)回收处理燃煤烟气中SO2的方法之一是用氨水先将SO2转化为NH4HSO3,再通入空气将其氧化成(NH4)2SO4。能提高燃煤烟气中SO2去除率的措施有__________(填字母)。
a.增大氨水浓度 b.增大燃煤烟气的流速 c.升高温度 d.增大压强