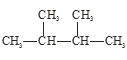
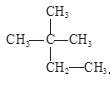
ЬтФПФкШн
ЁОЬтФПЁПЯТБэжаАЂРВЎЪ§зж(1ЁЂ2Ё)ЪЧдЊЫижмЦкБэжаааЛђСаЕФађКХЁЃЧыВЮеедЊЫиAЁЋIдкжмЦкБэжаЕФЮЛжУЃЌЛиД№ЯТСаЮЪЬтЁЃ
1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 | |
1 | A | |||||||
2 | B | C | D | E | ||||
3 | F | G | H | I |
(1)BЁЂCСНдЊЫижаЗЧН№ЪєадНЯЧПЕФЪЧ________(аДГідЊЫиУћГЦ)ЃЌIдЊЫидкжмЦкБэжаЕФЮЛжУЪЧ__________ЁЃ
(2)БэжаФГдЊЫиФмаЮГЩСНадбѕЛЏЮяЃЌаДГіИУбѕЛЏЮяШмгкЧтбѕЛЏФЦШмвКЕФРызгЗДгІЗНГЬЪН_________ЁЃ
(3)БэжаФГдЊЫиЕФЕЅжЪдкГЃЮТЯТЮЊЦјЬЌЃЌИУдЊЫиФмгыAЁЋIжаЕФвЛжждЊЫиЙЙГЩдзгИіЪ§БШЮЊ1ЁУ1КЭ1ЁУ2ЕФСНжжЙВМлЛЏКЯЮяXКЭYЃЌЧыаДГіYЕФЕчзгЪН_________ЃЌИУдЊЫиЛЙФмгыAЁЋIжаЕФСэвЛжждЊЫивддзгИіЪ§жЎБШЮЊ1ЁУ1КЭ1ЁУ2аЮГЩСНжжРызгЛЏКЯЮяZКЭMЃЌгУЕчзгЪНБэЪОMЕФаЮГЩЙ§ГЬЃК____ЁЃ
(4)БэжаФГСНжждЊЫиЕФЦјЬЌЕЅжЪПЩвдаЮГЩШМСЯЕчГиЃЌЦфВњЮяЧхНрЮоЮлШОЃЌЧыаДГіМюадЛЗОГжаИКМЋЗДгІЪН____ЁЃ
ЁОД№АИЁПЕЊ ЕкШ§жмЦкЕкЂїAзх Al2O3ЃЋ2OHЃ=2AlO2-ЃЋH2O ![]()
![]() H2-2e-+2OH-= 2H2O(Лђ 2H2-4e-+4OH-=4H2O )
H2-2e-+2OH-= 2H2O(Лђ 2H2-4e-+4OH-=4H2O )
ЁОНтЮіЁП
гЩдЊЫидкжмЦкБэжаЕФЮЛжУПЩжЊЃЌAЮЊЧтдЊЫиЃЌBЮЊЬМдЊЫиЃЌCЮЊЕЊдЊЫиЃЌDЮЊбѕдЊЫиЃЌEЮЊЗњдЊЫиЃЌFЮЊФЦдЊЫиЃЌGЮЊТСдЊЫиЃЌHЮЊЙшдЊЫиЃЌIЮЊТШдЊЫиЁЃ
(1)ЭЌжмЦкздзѓЖјгвЃЌЗЧН№ЪєаддіЧПЃЌЫљвдЗЧН№ЪєNЃОCЃЛIДІгкЕкШ§ааЃЌЕк17СаЃЌЮЊClдЊЫиЃЌДІгкжмЦкБэжаЕкШ§жмЦкЃЌЕкVIIAзхЃЛ
(2)ИУдЊЫиЮЊТСдЊЫиЃЌПЩаЮГЩСНадбѕЛЏЮяAl2O3ЃЌбѕЛЏТСгыЧтбѕЛЏФЦЗДгІЩњГЩЦЋТСЫсФЦгыЫЎЃЌРызгЗНГЬЪНЮЊAl2O3ЃЋ2OHЃ=2AlO2-ЃЋH2OЃЛ
(3)ИУдЊЫиЕФЕЅжЪдкГЃЮТЯТЮЊЦјЬЌЃЌдђЮЊHЁЂNЁЂOЁЂFЁЂClжаЕФвЛжжЃЌЦфжаФмгыAЁЋIЙЙГЩдзгИіЪ§БШЮЊ1ЁУ1КЭ1ЁУ2ЕФСНжжЙВМлЛЏКЯЮяЕФдЊЫижЛгаOЃЌдђXЮЊH2O2ЃЌYЮЊH2OЃЌЫЎЮЊЙВМлЛЏКЯЮяЃЌЕчзгЪНЮЊ![]() ЃЛФмгыNaаЮГЩРызгЛЏКЯЮяNa2O2КЭNa2OЃЌМДMЮЊNa2OЃЌЦфаЮГЩЙ§ГЬЮЊЃК
ЃЛФмгыNaаЮГЩРызгЛЏКЯЮяNa2O2КЭNa2OЃЌМДMЮЊNa2OЃЌЦфаЮГЩЙ§ГЬЮЊЃК![]() ЃЛ
ЃЛ
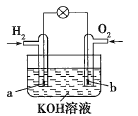
(4)ЧтЦјКЭбѕЦјПЩвдаЮГЩЧтбѕШМСЯЕчГиЃЌдЕчГижаИКМЋЗЂЩњбѕЛЏЗДгІЃЌЫљвдЧтЦјдкИКМЋЕУЕчзгЃЌгЩгкЕчНтжЪШмвКЮЊМюадЃЌЫљвдЩњГЩЫЎЃЌЕчМЋЗНГЬЪНЮЊЃКH2-2e-+2OH-= 2H2O(Лђ2H2-4e-+4OH-=4H2O)ЁЃ

 ЧсЫЩПЮЬУЕЅдЊЦкжаЦкФЉзЈЬтГхДЬ100ЗжЯЕСаД№АИ
ЧсЫЩПЮЬУЕЅдЊЦкжаЦкФЉзЈЬтГхДЬ100ЗжЯЕСаД№АИ