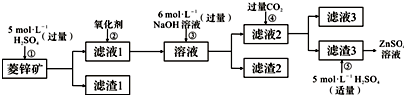
题目内容
11.下列反应或过程对能量的变化如图所示的是( )
| A. | H+H→H-H | B. | 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O | ||
| C. | Mg+2HCl=MgCl2+H2↑ | D. | H2SO4+2KOH=K2SO4+2H2O |
分析 依据图象分析,反应物能量低于生成物,反应是吸热反应,常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解反应以及某些复分解(如铵盐和强碱),常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应,据此判断;
解答 解:A、H+H→H-H,形成新键则需要放热,故A错误;
B、2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O,在反应中吸收热量,则属于吸热反应,故B正确;
C、Mg+2HCl=MgCl2+H2反应放出大量的热,则属于放热反应,故C错误;
D、H2SO4+2KOH=K2SO4+H2O反应放出大量的热,则属于放热反应,故D错误;
故选:B.
点评 本题考查化学反应的热量变化,学生应注重归纳中学化学中常见的吸热或放热的反应,对于特殊过程中的热量变化的要熟练记忆.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列说法正确的是( )
| A. | 浓硫酸可做为H2、NH3等气体的干燥剂 | |
| B. | 胆矾遇浓硫酸变白是因为浓硫酸的脱水性 | |
| C. | 足量的锌与一定量的浓硫酸反应会生成氢气 | |
| D. | 可用铝罐储运热的浓硫酸、浓硝酸 |
2.如图是四种常见有机物的比例模型示意图.下列说法正确的是( )
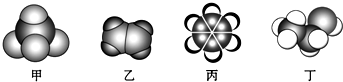

| A. | 甲能使酸性高锰酸钾溶液褪色 | |
| B. | 乙可与酸性高锰酸钾发生加成反应 | |
| C. | 丙中的碳碳键是介于碳碳单键和碳碳双键之间的独特的键 | |
| D. | 丁可与乙酸发生中和反应 |
19.下列每组物质发生状态变化所克服的粒子间的相互作用属于同类型的是( )
| A. | 食盐和氯化氢溶于水 | B. | 钠和硫熔化 | ||
| C. | 碘和干冰升华 | D. | 二氧化硅和氧化钠熔化 |
6.下列物质中既能使酸性高锰酸钾溶液又能使溴的四氯化碳溶液褪色的是( )
| A. | 甲苯 | B. | 乙烯 | C. | 环己烷 | D. | 聚苯乙烯 |
1.“北大富硒康”中含有微量元素硒(Se),对人体有保健作用.已知硒为第4周期ⅥA族元素,根据它在周期表中的位置推测硒不可能具有的性质为( )
| A. | 硒化氢不稳定 | |
| B. | 硒化氢的水溶液显弱酸性 | |
| C. | 得电子能力强于硫 | |
| D. | 其最高价氧化物的水化物酸性强于砷弱于溴 |
2.下列有关实验的说法正确的是( )
| A. | CH2=CH-CHO能使酸性高锰酸钾溶液褪色,证明该分子中一定含有碳碳双键 | |
| B. | 现向K2Cr2O7溶液中加入少量氢氧化钠,溶液变为黄色,证明溶液中存在着平衡:Cr2O72-+H2O?2CrO42-+2H+ | |
| C. | 用相互滴加的方法不能鉴别NaCl、AlCl3、Na2CO3、NaHSO4四种无色溶液 | |
| D. | SO2通入Ba(NO3)2溶液中出现白色沉淀,证明BaSO3不溶于水 |