题目内容
2.下列有关实验的说法正确的是( )| A. | CH2=CH-CHO能使酸性高锰酸钾溶液褪色,证明该分子中一定含有碳碳双键 | |
| B. | 现向K2Cr2O7溶液中加入少量氢氧化钠,溶液变为黄色,证明溶液中存在着平衡:Cr2O72-+H2O?2CrO42-+2H+ | |
| C. | 用相互滴加的方法不能鉴别NaCl、AlCl3、Na2CO3、NaHSO4四种无色溶液 | |
| D. | SO2通入Ba(NO3)2溶液中出现白色沉淀,证明BaSO3不溶于水 |
分析 A.醛基能被酸性高锰酸钾溶液氧化;
B.碱性条件下,促进重铬酸根离子水解;
C.只要相互滴加现象不同就能鉴别;
D.二氧化硫和硝酸钡反应生成硫酸钡.
解答 解:A.碳碳双键、醛基都能被酸性高锰酸钾溶液氧化,所以不能用酸性高锰酸钾溶液检验碳碳双键,故A错误;
B.NaOH电离出的氢氧根离子和氢离子反应,导致溶液颜色发生变化,所以说明存在水解平衡,故B正确;
C.AlCl3中滴加碳酸钠溶液时生成沉淀和气体、Na2CO3中滴加过量NaHSO4生成气体、NaCl和这几种物质都不反应,所以现象不同,可以采用相互滴加的方法鉴别,故C错误;
D.二氧化硫和硝酸钡发生氧化还原反应生成硫酸钡,能证明硫酸钡不溶于水,故D错误;
故选B.
点评 本题考查有机物结构和性质、物质鉴别、氧化还原反应等知识点,侧重考查学生分析判断能力,明确官能团及其性质关系、物质的性质等知识点即可解答,易错选项是D,很多同学往往认为沉淀是亚硫酸钡而导致错误,为易错点.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
11.下列反应或过程对能量的变化如图所示的是( )


| A. | H+H→H-H | B. | 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O | ||
| C. | Mg+2HCl=MgCl2+H2↑ | D. | H2SO4+2KOH=K2SO4+2H2O |
13.“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,有关说法正确的是( )


| A. | 转移0.1mol电子时,a电极产生1.12LH2 | |
| B. | b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH- | |
| C. | c电极上进行还原反应,B电池中的H+可以通过隔膜进入A池 | |
| D. | d电极上发生的电极反应是:O2+4H++4e-=2H2O |
7.某主族元素的电离能(单位:kJ•mol-1)如下表,此元素位于元素周期表的族数是( )
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 1011.8 | 1907 | 2914.1 | 4963.6 | 6273.9 | 21267 | 25431 |
| A. | ⅢA | B. | ⅣA | C. | ⅤA | D. | ⅥA |
14.常温下,石灰乳悬浊液中存在如下平衡:Ca(OH)2(s)═Ca2+(aq)+2OH-(ag),下列外界条件改变,石灰乳悬浊液中pH仍保持不变的是( )(不考虑固体与水热效应)
| A. | 加热 | B. | 加入少量CaO(s) | C. | 加入少量NaOH(s) | D. | 加入少量CaCl2(s) |
11.甲乙两种非金属,能说明甲比乙的非金属性强的是( )
①甲比乙容易与H2化合;②甲的气态氢化物比乙的气态氢化物稳定;③甲的氧化物对应的水化物的酸性比乙的氧化物对应的水化物酸性强;④与某金属反应时甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低.
①甲比乙容易与H2化合;②甲的气态氢化物比乙的气态氢化物稳定;③甲的氧化物对应的水化物的酸性比乙的氧化物对应的水化物酸性强;④与某金属反应时甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低.
| A. | ①②③ | B. | 只有⑤ | C. | ①②③④⑤ | D. | ①② |
12.现有三种元素的基态原子的电子排布式如下:
①3s23p4;②1s22s22p63s23p3;③1s22s22p5.则上述三种原子的第一电离能大小关系正确的是( )
①3s23p4;②1s22s22p63s23p3;③1s22s22p5.则上述三种原子的第一电离能大小关系正确的是( )
| A. | ②>①>③ | B. | ③>①>② | C. | ③>②>① | D. | ①>②>③ |
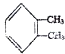 ;若C8H10分子中苯环上的一氯代物有三种,则其结构简式为
;若C8H10分子中苯环上的一氯代物有三种,则其结构简式为 或
或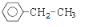 .
.