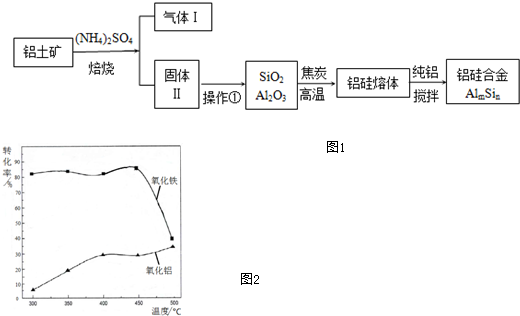
题目内容
4.锌钡白是一种白色颜料.工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓.请根据以下工业生产流程回答有关问题.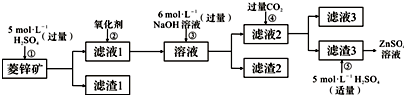
Ⅰ、ZnSO4溶液的制备与提纯:
有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2.
(1)②中使用的氧化剂最好是下列的D(选填字母代号).
A.Cl2 B.浓HNO3 C.KMnO4 D.H2O2
(2)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步①(选填①、②、③、⑤).
(3)写出步骤④后产生滤渣3的化学式Zn(OH)2.
(4)与Al相似,Zn也能溶于NaOH溶液.写出将Zn片和Cu片放入NaOH溶液中形成原电池的负极电极反应式:Zn-2e-+4OH-=ZnO22-+2H2O.
Ⅱ、BaS溶液的制备:
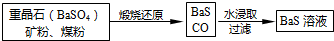
有关数据:Ba(s)+S(s)+2O2(g)=BaSO4(s)△H1=-1473.2kJ•mol-1
C(s)+1212O2(g)=CO(g)△H2=-110.5kJ•mol-1
Ba(s)+S(s)=BaS(s)△H3=-460kJ•mol-1
(5)若煅烧还原的产物仅为BaS和CO,则其反应的热化学方程式为:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ•mol-1.
Ⅲ、制取锌钡白:
(6)如果生产流程步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌钡白产生的后果是过量的酸与BaS溶液混合会产生有毒的H2S污染空气,而且会降低锌钡白的产率.
分析 I.由图或者流程可知,菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等,加硫酸,只有SiO2不反应,经过过滤进行分离,则滤渣1为SiO2,滤液1含有硫酸铜、硫酸亚铁、硫酸锌、剩余的硫酸,②加氧化剂将亚铁离子氧化为铁离子,再加过量的NaOH,Zn2+转化ZnO22-,使Cu2+、Fe3+转化为沉淀,通过过滤从溶液中除去,则滤渣2为Fe(OH)3、Cu(OH)2,滤液2中含有Na2ZnO2及过量的NaOH,④通二氧化碳将ZnO22-转化为沉淀,则滤渣3为Zn(OH)2,步骤⑤主要发生氢氧化锌与硫酸的反应,滤液3含有碳酸氢钠.
(1)加氧化剂将亚铁离子氧化为铁离子,不能引入新杂质;
(2)上述各步骤中,只有步骤①中有二氧化碳生成;
(3)步骤④通二氧化碳将ZnO22-转化为Zn(OH)2;
(4)Zn与NaOH溶液反应,Zn作负极,发生氧化反应失去电子,碱性条件下生成ZnO22-与H2O;
Ⅱ.(5)煅烧发生反应:BaSO4+C高温_BaS+4CO↑,根据已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式;
Ⅲ.(6)步骤⑤中硫酸过量,过量的酸与BaS溶液混合会发生反应,产生有毒的H2S污染空气,而且会降低锌钡白的产率.
解答 解:I.由图或者流程可知,菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等,加硫酸,只有SiO2不反应,经过过滤进行分离,则滤渣1为SiO2,滤液1含有硫酸铜、硫酸亚铁、硫酸锌、剩余的硫酸,②加氧化剂将亚铁离子氧化为铁离子,再加过量的NaOH,Zn2+转化ZnO22-,使Cu2+、Fe3+转化为沉淀,通过过滤从溶液中除去,则滤渣2为Fe(OH)3、Cu(OH)2,滤液2中含有Na2ZnO2及过量的NaOH,④通二氧化碳将ZnO22-转化为沉淀,则滤渣3为Zn(OH)2,步骤⑤主要发生氢氧化锌与硫酸的反应,滤液3含有碳酸氢钠.
(1)加氧化剂将亚铁离子氧化为铁离子,不能引入新杂质,氯气做氧化剂会引入氯离子,且氯气有毒,浓HNO3做氧化剂会被还原为有毒气体,引入杂质离子NO3-,KMnO4 做氧化剂会引入K+、MnO4-,过氧化氢做氧化剂被还原为水,不引入新的杂质,过量的过氧化氢加热分解生成氧气和水,
故选:D;
(2)上述各步骤中,只有步骤①中有二氧化碳生成,故选:①;
(3)步骤④通二氧化碳将ZnO22-转化为Zn(OH)2,则滤渣3为Zn(OH)2,故答案为:Zn(OH)2;
(4)Zn与NaOH溶液反应,Zn作负极,发生氧化反应失去电子,碱性条件下生成ZnO22-与H2O,负极电极反应式为:Zn-2e-+4OH-=ZnO22-+2H2O,故答案为:Zn-2e-+4OH-=ZnO22-+2H2O;
Ⅱ.(5)煅烧发生反应:BaSO4+C高温_BaS+4CO↑,
已知:①Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ•mol-1
②C(s)+12O2(g)=CO(g);△H=-110.5kJ•mol-1
③Ba(s)+S(s)=BaS(s);△H=-460kJ•mol-1
依据盖斯定律,②×4-③-①得到热化学方程式为:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ•mol-1,
故答案为:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ•mol-1;
Ⅲ.(6)步骤⑤中硫酸过量,过量的酸与BaS溶液混合会发生反应,产生有毒的H2S污染空气,而且会降低锌钡白的产率,
故答案为:过量的酸与BaS溶液混合会产生有毒的H2S污染空气,而且会降低锌钡白的产率.
点评 本题考查物质制备工艺流程,涉及物质的分离提纯、对操作步骤及试剂的分析评价、电极反应式书写、热化学方程式书写等,理解工艺流程原理是解题关键,题目难度中等.

| A. | 易液化,可用作制冷材料 | |
| B. | CO2晶体中,每个C原子周围结合2个O原子,每个O原子跟1个C原子结合 | |
| C. | 硬度很大,可用作耐磨材料 | |
| D. | 在一定条件下,CO2分子晶体转化为原子晶体是物理变化 |
| A. | CH4 | B. | C2H4 | C. | C3H4 | D. | C6H6 |

| A. | H+H→H-H | B. | 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O | ||
| C. | Mg+2HCl=MgCl2+H2↑ | D. | H2SO4+2KOH=K2SO4+2H2O |
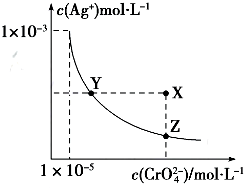
| A. | t℃时,Ag2CrO4的Ksp为1×10-12 | |
| B. | t℃时,向饱和Ag2CrO4溶液中加入K2CrO4溶液,再次平衡时c2(Ag+)×c(CrO42-)>Ksp | |
| C. | t℃时,Ksp(AgCl)=1.56×10-10 | |
| D. | t℃时,用0.01mol•L-1 AgNO3溶液滴定20mL 0.01mol•L-1KCl和0.01mol K2CrO4的混合溶液,CrO2−4先沉淀 |

| A. | 转移0.1mol电子时,a电极产生1.12LH2 | |
| B. | b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH- | |
| C. | c电极上进行还原反应,B电池中的H+可以通过隔膜进入A池 | |
| D. | d电极上发生的电极反应是:O2+4H++4e-=2H2O |
| A. | 加热 | B. | 加入少量CaO(s) | C. | 加入少量NaOH(s) | D. | 加入少量CaCl2(s) |