题目内容
19.下列每组物质发生状态变化所克服的粒子间的相互作用属于同类型的是( )| A. | 食盐和氯化氢溶于水 | B. | 钠和硫熔化 | ||
| C. | 碘和干冰升华 | D. | 二氧化硅和氧化钠熔化 |
分析 A.氯化钠含有离子键,氯化氢含有共价键;
B.钠为金属单质含有金属键,硫为分子晶体,熔化破坏分子间作用力;
C.碘和干冰都是分子晶体,受热升华均破坏分子间作用力;
D.二氧化硅为原子晶体,氧化钠为离子晶体,含有离子键.
解答 解:A.食盐和氯化氢溶于水,前者破坏离子键,后者破坏共价键,故A不选;
B.钠和硫熔化,前者破坏金属键,后者破坏分子间作用力,故B不选;
C.碘和干冰都是分子晶体,受热升华均破坏分子间作用力,故C选;
D.二氧化硅和氧化钠熔化,前者破坏共价键,后者破坏离子键,故D不选;
故选:C.
点评 本题考查了化学键与分子间作用力区别,明确物质的晶体类型及结构是解题关键,题目难度不大,注意分子间作用力只影响物质的物理性质,不影响化学性质.

练习册系列答案
相关题目
9.下列各组元素性质或原子结构递变情况错误的是( )
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正化合价依次增大 | |
| C. | N、O、F原子半径依次增大 | |
| D. | Na、K、Rb的电子层数依次增多 |
10.有机物CH2=CH-CH2-CH(OH)-COOH可发生下列反应中的哪几类( )
(1)使溴水褪色 (2)使高锰酸钾溶液褪色 (3)与钠反应 (4)加聚反应
(5)酯化反应 (6)水解反应 (7)取代反应.
(1)使溴水褪色 (2)使高锰酸钾溶液褪色 (3)与钠反应 (4)加聚反应
(5)酯化反应 (6)水解反应 (7)取代反应.
| A. | 除(7)外都可以 | B. | 除(6)外都可以 | C. | (1)(2)(3)(7) | D. | (1)(2)(3)(5) |
7.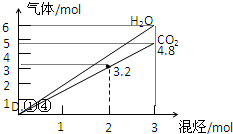 两种气态烃组成的混合气体完全燃烧后得到CO2和H2O的物质的量随混合烃的总物质的量的变化如图所示,
两种气态烃组成的混合气体完全燃烧后得到CO2和H2O的物质的量随混合烃的总物质的量的变化如图所示,
则下列对混合烃的判断正确的是( )
①一定有乙烯;②一定有甲烷;③一定有丙烷;
④一定无乙烷;⑤可能有乙烷;⑥可能有丙炔.
 两种气态烃组成的混合气体完全燃烧后得到CO2和H2O的物质的量随混合烃的总物质的量的变化如图所示,
两种气态烃组成的混合气体完全燃烧后得到CO2和H2O的物质的量随混合烃的总物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
①一定有乙烯;②一定有甲烷;③一定有丙烷;
④一定无乙烷;⑤可能有乙烷;⑥可能有丙炔.
| A. | ②③⑤ | B. | ⑤⑥ | C. | ②④⑥ | D. | ①④ |
14.等质量的下列烃完全燃烧时,消耗氧气的量最多的是( )
| A. | CH4 | B. | C2H4 | C. | C3H4 | D. | C6H6 |
4.进行一氯取代反应后,只能生成3种沸点不同的有机产物的烷烃是( )
| A. | (CH3)2CHCH2CH2CH3 | B. | (CH3)3CCH2CH3 | C. | (CH3)2CHCH(CH3)2 | D. | (CH3CH2)2CHCH3 |
11.下列反应或过程对能量的变化如图所示的是( )


| A. | H+H→H-H | B. | 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O | ||
| C. | Mg+2HCl=MgCl2+H2↑ | D. | H2SO4+2KOH=K2SO4+2H2O |
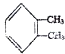 ;若C8H10分子中苯环上的一氯代物有三种,则其结构简式为
;若C8H10分子中苯环上的一氯代物有三种,则其结构简式为 或
或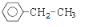 .
.