题目内容
8.有关下列图象的分析错误的是( )| A. | 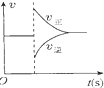 图可表示对平衡N2+3H2?2NH3加压、同时移除部分NH3时的速率变化 | |
| B. | 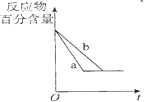 图中a、b曲线只可表示反应H2(g)十I2(g)?2HI(g)在有催化剂和无催化剂存在下建立平衡的过程 | |
| C. | 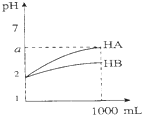 图表示室温下将各1 ml pH=2的HA、HB两种酸溶液加水稀释的情况.若2<a<5,则两酸都为弱酸 | |
| D. | 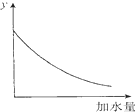 图中的y可表示将O.1 mol/l稀醋酸加水稀释时溶液导电能力的变化情况 |
分析 A、对平衡N2+3H2?2NH3加压、同时移除部分NH3时,v正先增大后减小,v逆先减小后增大;
B、反应H2(g)十I2(g)?2HI(g)反应前后气体体积不变,减小容器体积与加入催化剂效果相同;
C、强酸溶液的体积每增大10n倍,酸溶液pH增大n;
D、O.1 mol/l稀醋酸加水稀释时溶液中离子浓度减小.
解答 解:A、对平衡N2+3H2?2NH3加压、同时移除部分NH3时,平衡正向移动,v正先增大后减小,v逆先减小后增大,与图象符合,故A正确;
B、图中a、b曲线除可表示反应H2(g)十I2(g)?2HI(g)在有催化剂和无催化剂存在下建立平衡的过程,还可以表示压强不同时建立平衡的过程,故B错误;
C、HA、HB两种酸溶液加水稀释103倍,其pH变化小于3,说明两酸都为弱酸,故C正确;
D、稀醋酸加水稀释时溶液中离子浓度减小,溶液导电能力减弱,故D正确.
故选B.
点评 本题考查了化学反应速率图象、外界条件对平衡建立过程的影响图象、加水稀释溶液时pH和离子浓度的变化,题目难度不大.

练习册系列答案
相关题目
18.下列实验操作错误的是( )
| A. |  检查气密性 | B. |  稀释浓硫酸 | C. |  称取氯化钠 | D. |  过滤粗盐水 |
19.燃烧质量相同的下列各有机物时,消耗氧气的量最多的是( )
| A. | 乙醇 | B. | 丙醇 | C. | 乙二醇 | D. | 丙三醇 |
16.下列表示元素的基态原子的电子排布式,其中表示的元素属于第三周期的元素的是( )
| A. | 1s22s1 | B. | 1s22s22p5 | ||
| C. | 1s22s22p63s2 | D. | 1s22s22p63s23p64s1 |
3.下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(4)小题用元素符号或化学式回答,(5)~(8)小题按题目要求回答.
(1)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是O、F.氧化性最强的单质是F2,还原性最强的单质是Na.
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(3)A分别与D、E、F、H、I形成的化合物中,最稳定的HF,
(4)在B、C、E、F、H、I中,原子半径最大的是Na,
(5)D和G组成化合物的电子式 ,
,
(6)A和E组成化合物可否用浓硫酸干燥不能;原因是:2NH3+H2SO4=(NH4)2SO4(用化学方程式回答)
(7)B与G形成1:1型化合物中含有的化学键类型离子键、共价键,
(8)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | H | J | |||
| 3 | B | C | F | I |
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(3)A分别与D、E、F、H、I形成的化合物中,最稳定的HF,
(4)在B、C、E、F、H、I中,原子半径最大的是Na,
(5)D和G组成化合物的电子式
 ,
,(6)A和E组成化合物可否用浓硫酸干燥不能;原因是:2NH3+H2SO4=(NH4)2SO4(用化学方程式回答)
(7)B与G形成1:1型化合物中含有的化学键类型离子键、共价键,
(8)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
13.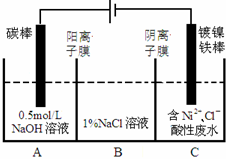 工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是已知:
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是已知:
①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)( )
 工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是已知:
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)( )
| A. | 碳棒上发生的电极反应:4OH--4e-═O2↑+2H2O | |
| B. | 为了提高Ni的产率,电解过程中需要控制废水pH | |
| C. | 电解过程中,B中NaCl溶液的物质的量浓度将不断减小 | |
| D. | 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变 |
20.标准状况下,某同学向100mL H2S饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中正确的是( )
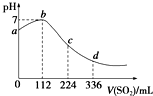

| A. | b点对应的溶液导电性最强 | |
| B. | 亚硫酸是比氢硫酸更弱的酸 | |
| C. | ab段反应是SO2+2H2S═3S↓+2H2O | |
| D. | 原H2S溶液的物质的量浓度为0.05mol•L-1 |
17.用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术.已知反应:Fe2O3+3Na2O2=2Na2FeO4+Na2O,下列说法正确的是( )
| A. | Na2O2既是氧化剂又是还原剂 | |
| B. | Na2FeO4既是氧化产物又是还原产物 | |
| C. | 3molNa2O2发生反应,有12mol电子转移 | |
| D. | Na2FeO4在水中被氧化得到Fe3+,Fe3+水解生成氢氧化铁,可净水 |
18.只能用排水集气法的气体是( )
| A. | NH3 | B. | Cl2 | C. | HCl | D. | NO |