题目内容
20.标准状况下,某同学向100mL H2S饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中正确的是( )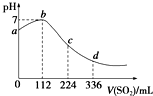
| A. | b点对应的溶液导电性最强 | |
| B. | 亚硫酸是比氢硫酸更弱的酸 | |
| C. | ab段反应是SO2+2H2S═3S↓+2H2O | |
| D. | 原H2S溶液的物质的量浓度为0.05mol•L-1 |
分析 H2S 饱和溶液中通入SO2,发生反应:SO2+2H2S=3S↓+2H2O,随着反应的进行,溶液酸性逐渐减弱,但恰好反应时,溶液呈中性,二氧化硫过量,与水反应生成亚硫酸,溶液酸性逐渐增强,根据图象可知恰好反应时消耗二氧化硫112mL,根据方程式可知原溶液中硫化氢为0.01mol,通入336mL二氧化硫时,亚硫酸的浓度与原氢硫酸浓度相等,二者都是二元酸,溶液中亚硫酸pH值更小,故亚硫酸的酸性更强,以此解答该题.
解答 解:A.b点为中性,只有水,导电性最差,故A错误;
B.根据图象可知恰好反应时消耗二氧化硫112mL,n(SO2)=$\frac{0.112L}{22.4L/mol}$=0.005mol,根据方程式可知原溶液中硫化氢为0.01mol,通入336mL二氧化硫时,溶液中亚硫酸为0.01mol,亚硫酸的浓度与原氢硫酸浓度相等,二者都是二元酸,溶液中亚硫酸pH值更小,故亚硫酸的酸性比氢硫酸更强,故B错误;
C.ab段pH在增大,由酸性到中性,则发生的反应是SO2+2H2S=3S↓+2H2O,故C正确;
D.由图可知,112mLSO2与硫化氢恰好完全反应,则n(SO2)=$\frac{0.112L}{22.4L/mol}$=0.005mol,由方程式可知n(H2S)=0.01mol,则原H2S溶液的物质的量浓度为$\frac{0.01mol}{0.1L}$=0.1mol/L,故D错误.
故选C.
点评 本题考查硫元素化合物性质、化学反应图象等,明确发生的化学反应是解答的关键,注意B选项中应根据溶液物质的浓度相等时pH大小进行判断,学生容易根据已有知识回答,为解答易错点,题目难度中等.

练习册系列答案
相关题目
8.有关下列图象的分析错误的是( )
| A. | 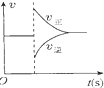 图可表示对平衡N2+3H2?2NH3加压、同时移除部分NH3时的速率变化 | |
| B. | 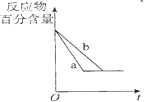 图中a、b曲线只可表示反应H2(g)十I2(g)?2HI(g)在有催化剂和无催化剂存在下建立平衡的过程 | |
| C. | 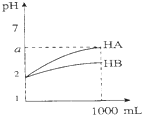 图表示室温下将各1 ml pH=2的HA、HB两种酸溶液加水稀释的情况.若2<a<5,则两酸都为弱酸 | |
| D. | 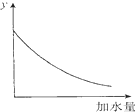 图中的y可表示将O.1 mol/l稀醋酸加水稀释时溶液导电能力的变化情况 |
5.任何科学真理的发现,都不是一帆风顺的,门捷列夫的元素周期表奠定了现代化学和物理学的理论基础.下列关于元素周期表的说法中,不正确的是( )
| A. | 周期表中的副族、Ⅷ族都是金属元素 | |
| B. | 周期表中的ⅡA族都是金属元素 | |
| C. | 周期表中的非金属元素都位于短周期 | |
| D. | 周期表中的0族元素都是非金属元素 |
10.在强酸性溶液中能大量共存,并且溶液为无色透明的离子组是( )
| A. | K+、Na+、CO32-、NO3- | B. | NH4+、Al3+、SO42-、NO3- | ||
| C. | NH4+、K+、MnO4-、SO42- | D. | Ca2+、Na+、NO3-、HSO3- |

 .
.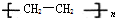 (塑料)、
(塑料)、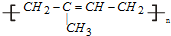 (橡胶).
(橡胶).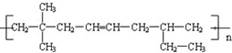 的单体为CH2=C(CH3)2、CH2=CH-CH=CH2、CH2=CHCH2CH3.
的单体为CH2=C(CH3)2、CH2=CH-CH=CH2、CH2=CHCH2CH3. .
.