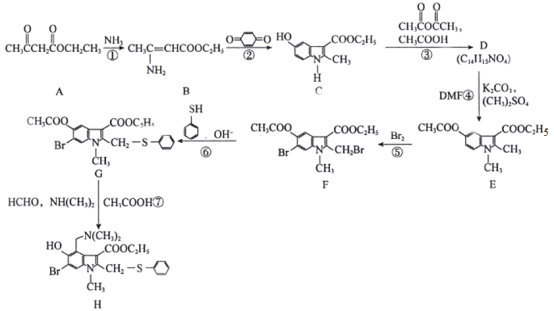
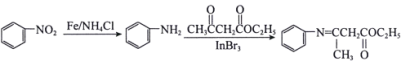
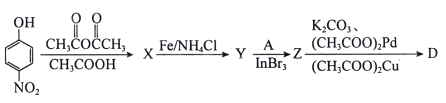
题目内容
【题目】催化剂在现代化学工业中占有极其重要的地位,主要涉及过渡元素及其化合物、硅、铝化合物等。中国科学家创造性地构建了硅化物晶格限域的单铁中心催化剂,成功地实现了甲烷在无氧条件下选择活化,一步高效生产乙烯、芳烃和氢气等化学品。
(1)硅、碳位于同一主族,用“>”“<”或“=”填空:
性质 | 原子半径 | 第一电离能 | 熔点 | 键能 |
项目 | ①Si__________C | ②C_________Si | ③CO2______SiO2 | ④H-Si_______H-C |
(2)CN-能与Fe3+形成配合物,与CN-互为等电子体的分子有_____________(任写一种);1mol[Fe(CN)6]3-中含____________mol σ键。
(3)已知:反应2CH4![]() CH2=CH2+2H2,碳原子的杂化类型转化过程为___________;
CH2=CH2+2H2,碳原子的杂化类型转化过程为___________;
(4)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___________方法区分晶体、准晶体和非晶体。
(5)基态F原子的价层电子排布图为___________。
(6)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为____________。
(7)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1g·cm-3。
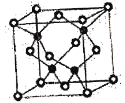
①CuF的熔点比CuCl的高,原因是____________________________________________。
②已知NA为阿伏加德罗常数的值,CuF的晶胞结构如图所示,则CuF的晶胞参数a=__________nm(列出计算式)。
【答案】> > < < N2(或CO等) 12 sp3转化成sp2 X射线衍射 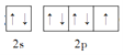 V形 CuCl为分子晶体,CuF为离子晶体
V形 CuCl为分子晶体,CuF为离子晶体 ![]() ×107
×107
【解析】
(1)①Si原子电子层数为3,C原子电子层数为2,所以半径Si>C;
②Si原子电子层数为3,C原子电子层数为2,所以C原子的原子核对核外电子的吸引能力更强,第一电离能更大;
③二氧化硅为原子晶体,二氧化碳为分子晶体,所以熔点:CO2>SiO2;
④Si原子半径更大,所以键能H-Si<H-C;
(2)原子总数相同,价电子总数也相同的分子或离子互为等电子体,CN-的原子数为2,价电子数为10,用N原子替换C原子与1个单位负电荷,或者用O原子替换N原子与1个单位负电荷,得到与CN-互为等电子体的分子为:N2或CO等;[Fe(CN)6]3-中Fe3+与CN-形成6个配位键,CN-中有1个σ键,故[Fe(CN)6]3-中共有12个σ键,1mol[Fe(CN)6]3-中含12molσ键;
(3)CH4为正四面体结构,C原子采取sp3杂化,CH2=CH2为平面结构,C原子采取sp2杂化,碳原子的杂化类型转化过程为:sp3杂化转化为sp2杂化;
(4)可通过X射线衍射实验方法区分晶体、准晶体和非晶体;
(5)F为9号原子,所以基态F原子的价层电子为2s22p5,排布图为 ;
;
(6)该离子中心原子价层电子对数为![]() =4,含有2对孤电子对,所以空间构型为V形;
=4,含有2对孤电子对,所以空间构型为V形;
(7)①根据CuCl熔化时几乎不导电可知其为分子晶体,熔点较低,而CuF为离子晶体,熔点较高;
②根据均摊法晶胞中F-个数为4,化学式为CuF,所以Cu+个数也为4,则晶胞的质量m=![]() g,晶胞的体积为a3nm3,晶胞密度为7.1g·cm-3=7.1×10-21 g·nm-3
g,晶胞的体积为a3nm3,晶胞密度为7.1g·cm-3=7.1×10-21 g·nm-3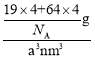 ,解得a=
,解得a=![]() ×107nm。
×107nm。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案【题目】HClO4、H2SO4、HNO3和HCl都是强酸,它们的酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
下列说法中不正确的是( )
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中HClO4是这四种酸中最强的酸
C.在冰醋酸中H2SO4的电离方程式为H2SO4===2H++SO![]()
D.水不能区分这四种酸的强弱,但冰醋酸可以区分这四种酸的强弱