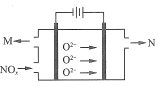
题目内容
【题目】(1)实验室制氯气的尾气处理用_____溶液吸收,其化学反应方程式为_____。
(2)向AlCl3溶液中逐滴加入NaOH溶液,现象是先产生白色沉淀,其反应的离子方程式为_____,后白色沉淀又溶解消失,其反应的离子方程式为_____。
(3)在含有0.2mol的硫酸和0.2mol的硝酸的混合溶液200mL中,加入19.2g铜粉,产生的气体成分为_____(填NO或H2),你所选气体在标准状况下的体积为_____L
【答案】NaOH 2NaOH+Cl2=NaCl+NaClO+H2O Al3++3OH﹣=Al(OH)3↓ Al(OH)3+OH﹣=AlO2﹣+2H2O NO 3.36L
【解析】
(1)实验室用氢氧化钠溶液吸收多余的氯气;
(2)铝离子和氢氧根反应生成氢氧化铝沉淀,氢氧化铝为两性氢氧化物,溶解于强碱中;
(3)硫酸和硝酸都为稀酸,反应方程式为铜与稀硝酸反应。
(1)实验室用氢氧化钠溶液吸收多余的氯气,防止污染空气;氯气和氢氧化钠反应生成氯化钠和次氯酸钠、水,反应方程式为:2NaOH+Cl2=NaCl+NaClO+H2O,
故答案为:NaOH;2NaOH+Cl2=NaCl+NaClO+H2O;
(2)向AlCl3溶液中逐滴加入NaOH溶液,现象是先产生白色沉淀,是铝离子和氢氧根反应生成氢氧化铝沉淀,离子方程式为:Al3++3OH﹣=Al(OH)3↓;后白色沉淀又溶解消失,是因为氢氧化铝为两性氢氧化物,溶解于强碱中,生成偏铝酸钠和水,离子方程式为:Al(OH)3+OH﹣=AlO2﹣+2H2O,
故答案为:Al3++3OH﹣=Al(OH)3↓;Al(OH)3+OH﹣=AlO2﹣+2H2O;
(3)0.2mol的硫酸和0.2mol的硝酸的混合溶液200mL中,硫酸和硝酸都为稀酸,加入19.2g铜粉,且氢离子不足,完全反应,设n(NO)=x,
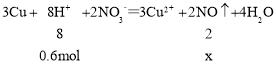
x=0.15mol,V(NO)=n×Vm=0.15×22.4=3.36L,故答案为:NO;3.36L。

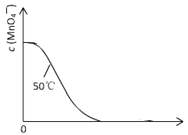
【题目】某小组拟用酸性KMnO4溶液与H2C2O4溶液的反应(此反应为放热反应)来探究“条件对化学反应速率的影响”,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol/L H2C2O4溶液、0.010 mol/L KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽。
物理量 编号 | V(0.20 mol/L H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010 mol/L酸性KMnO4溶液)/mL | m(MnSO4)/g | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 0 | 50 | |
② | 2.0 | 0 | 4.0 | 0 | 25 | |
③ | 1.5 | a | 4.0 | 0 | 25 | |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
性质 | 原子半径 | 第一电离能 | 熔点 | 键能 |
项目 | ①Si__________C | ②C_________Si | ③CO2______SiO2 | ④H-Si_______H-C |
(2)CN-能与Fe3+形成配合物,与CN-互为等电子体的分子有_____________(任写一种);1mol[Fe(CN)6]3-中含____________mol σ键。
(3)已知:反应2CH4![]() CH2=CH2+2H2,碳原子的杂化类型转化过程为___________;
CH2=CH2+2H2,碳原子的杂化类型转化过程为___________;
(4)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___________方法区分晶体、准晶体和非晶体。
(5)基态F原子的价层电子排布图为___________。
(6)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为____________。
(7)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1g·cm-3。
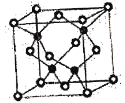
①CuF的熔点比CuCl的高,原因是____________________________________________。
②已知NA为阿伏加德罗常数的值,CuF的晶胞结构如图所示,则CuF的晶胞参数a=__________nm(列出计算式)。