题目内容
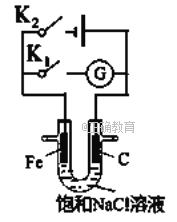
【题目】如图所示:

(1)①该反应是__________反应(填“吸热”或“放热”)。
②当反应达到平衡时,升高温度,A的转化率__________(填“增大”“减小”“不变”)。
③在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1__________,E2__________(填“增大”“减小”“不变”)。
(2)101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量,表示H2燃烧热的化学方程式__________。
【答案】放热 减小 减小 减小 H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ/mol
【解析】
(1) ①由图象可以知道该反应是一个能量降低的反应,所以属于放热反应,因此答案是:放热;
②由图知A(g)+B(g)=C(g)+D(g) ΔH<0,所以升高温度,平衡逆向移动,A的浓度增大,A的转化率减小,因此答案是:减小;
③加入催化剂改变了反应的途径,降低正逆反应所需的活化能,所以E1和E2的变化都减小,因此答案是:减小;减小;
(2) 燃烧热指1 mol可燃物完全燃烧生成稳定氧化物时放出的热量,所以表示H2燃烧热的化学方程式为H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ/mol,故答案为:H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ/mol。

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目