题目内容
【题目】(1).对于下列反应:2SO2 + O2 ![]() 2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为__________,用O2浓度变化来表示的反应速率为__________。
2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为__________,用O2浓度变化来表示的反应速率为__________。
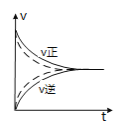
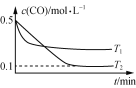
(2)反应N2+3H2![]() 2NH3 ΔH<0 ,达平衡后,不同时刻改变外界条件时正逆反应速率变化如图,请判断某时刻所改变的条件。
2NH3 ΔH<0 ,达平衡后,不同时刻改变外界条件时正逆反应速率变化如图,请判断某时刻所改变的条件。

可能改变的外界条件:t1__________,t2__________ ,t3__________。
【答案】2mol /(Lmin) 1mol /(Lmin) 降低温度 增大压强 加入催化剂
【解析】
(1)根据v=△c/△t结合化学反应速率之比等于化学计量数之比计算;
(2)根据正逆反应速率的变化结合温度、压强对反应速率和化学平衡的影响判断。
(1)v(SO2)=(6mol/L2mol/L)/2min=2mol/(Lmin),根据反应方程式的化学计量数关系可知v(O2)=1/2v(SO2)=1mol/(Lmin),故答案为:2mol/(Lmin);1mol/(Lmin);
(2)t1时,正反应速率大于逆反应速率,且正、逆反应速率都减小,说明平衡应向正反应方向移动,该反应的正反应放热,反应条件应为降低温度;t2时,正反应速率大于逆反应速率,且正、逆反应速率都增大,说明平衡应向正反应方向移动,该反应为气体体积增大的反应,反应条件应为增大压强;t3时,正反应速率等于逆反应速率,且正、逆反应速率都增大,说明平衡应不移动,反应条件应为加入催化剂。

 长江作业本同步练习册系列答案
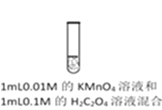
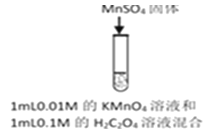
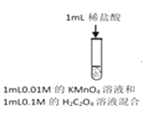
长江作业本同步练习册系列答案【题目】资料显示:自催化作用是指反应产物之一使该反应速率加快的作用。用稀硫酸酸化的KMnO4进行下列三组实验,一段时间后溶液均褪色(0.01mol/L可以记做0.01M)。
实验① | 实验② | 实验③ |
|
|
|
褪色 | 比实验①褪色快 | 比实验①褪色快 |
下列说法不正确的是
A. 实验①中发生氧化还原反应,H2C2O4是还原剂,产物MnSO4能起自催化作用
B. 实验②褪色比①快,是因为MnSO4的催化作用加快了反应速率
C. 实验③褪色比①快,是因为Cl—的催化作用加快了反应速率
D. 若用1mL0.2M的H2C2O4做实验①,推测比实验①褪色快