题目内容
【题目】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe基态原子结构示意图__________。
(2)丙酮( )分子中各元素电负性从大到小顺序是________,1 mol丙酮分子中含有σ键的数目为________。
)分子中各元素电负性从大到小顺序是________,1 mol丙酮分子中含有σ键的数目为________。
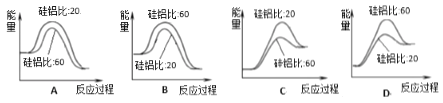
(3)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为________。


(4)科学家制得由20个碳原子组成的 空心笼状分子C20,该笼状结构是由许多正五边形构成(如图)。

请回答:一个 C20分子共有_______条棱边,推测C20晶体的硬度_______(填较大或较小)
【答案】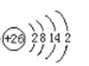 O>C>H 9 NA Fe3CuN 30 较小
O>C>H 9 NA Fe3CuN 30 较小
【解析】
(1)铁为26号元素,根据核外电子排布规律画出原子结构示意图;
(2)非金属性越强电负性越大;![]() 中单键均为σ键,双键中含1个σ键,甲基上C形成4个σ键,C=O中C形成3个σ键;
中单键均为σ键,双键中含1个σ键,甲基上C形成4个σ键,C=O中C形成3个σ键;
(3)由图2可知,Cu替代a位置的Fe时能量较低,更稳定,则Cu位于顶点,N(Cu)=8×![]() =1,Fe位于面心,N(Fe)=6×
=1,Fe位于面心,N(Fe)=6×![]() =3,N位于体心;
=3,N位于体心;
(4)利用均摊法分析晶体结构,每个碳原子与另外3个碳原子成键,2个原子形成一个键,以此来解答。
(1)Fe的原子序数为26,原子结构示意图为: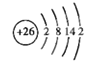 ,
,
故答案为: ;
;
(2)非金属性越强,电负性越大,则C、H、O三种元素的电负性由大到小的顺序为O>C>H;![]() 中单键均为σ键,双键中含1个σ键,甲基上C形成4个σ键,C=O中C形成3个σ键,1mol丙酮共有9molσ键,数目为9NA个,
中单键均为σ键,双键中含1个σ键,甲基上C形成4个σ键,C=O中C形成3个σ键,1mol丙酮共有9molσ键,数目为9NA个,
故答案为:O>C>H;9NA;
(3)由图2可知,Cu替代a位置的Fe时能量较低,更稳定,则Cu位于顶点,N(Cu)=8×![]() =1,Fe位于面心,N(Fe)=6×
=1,Fe位于面心,N(Fe)=6×![]() =3,N位于体心,则只有1个N,其化学式为Fe3CuN,
=3,N位于体心,则只有1个N,其化学式为Fe3CuN,
故答案为:Fe3CuN;
(4)从分子结构示意图可以看出,在C20分子内每个碳原子与另外3个碳原子成键,因此,C20分子键总数=20×3×![]() (因为2个原子形成一个键),也即C20分子中共有30条棱边(因为化学键总数=多面体棱边总数)。
(因为2个原子形成一个键),也即C20分子中共有30条棱边(因为化学键总数=多面体棱边总数)。
C20与C60都属于碳的同素异形体,应属于分子晶体,所以推测C20晶体的硬度较小;
故答案为:30;较小。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案